题目内容
7.容积均为2L的甲乙丙三个恒容密闭容器中均加入0.10mol/L的N2、0.26mol/L的H2,进行合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数.下列判断不正确的是( )
| A. | 图2 中反应速率最快的是容器丙 | |
| B. | 图1 中容器乙的反应可能使用了催化剂 | |
| C. | 图l 中容器乙0~5 min时间内v${\;}_{({N}_{2})}$=0.012mol/(L•min) | |
| D. | 图1 中容器丙内反应的平衡常数为2.5 |
分析 A.由图2可知,丙中温度最高,反应速率最快;
B.由图1可知,甲、乙的平衡浓度相同,但乙中时间短;
C.结合v=$\frac{△c}{△t}$计算;
D.由图1可知,氮气开始的浓度为0.1mol/L,平衡浓度为0.08mol/L,则
N2(g)+3H2(g)?2NH3(g)
开始 0.1 0.26 0
转化 0.02 0.06 0.04
平衡 0.08 0.2 0.04
结合平衡浓度计算K.
解答 解:A.温度越高,反应速率越快,由图2可知,丙中温度最高,反应速率最快,故A正确;
B.由图1可知,甲、乙的平衡浓度相同,但乙中时间短,图1 中容器乙的反应可能使用了催化剂,故B正确;
C.图l 中容器乙0~5 min时间内v${\;}_{({N}_{2})}$=$\frac{0.1mol/L-0.06mol/L}{5min}$=0.008mol/(L•min),故C错误;
D.由图1可知,氮气开始的浓度为0.1mol/L,平衡浓度为0.08mol/L,则
N2(g)+3H2(g)?2NH3(g)
开始 0.1 0.26 0
转化 0.02 0.06 0.04
平衡 0.08 0.2 0.04
K=$\frac{0.0{4}^{2}}{0.08×0.{2}^{3}}$=2.5,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、速率的计算及平衡移动为解答的关键,侧重分析与计算能力的考查,注意判断浓度的变化,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 浓盐酸 | B. | 浓硫酸 | C. | 浓硝酸 | D. | 稀硫酸 |
| A. | 若X为O,则Y、X形成的常见化合物一定是离子化合物 | |
| B. | 若X是Na,则Z的最高正价一定是偶数 | |
| C. | 若Y为O,则非金属性:X<Y<Z | |
| D. | 若Y为Na,则X、Z不可能是同一主族元素 |
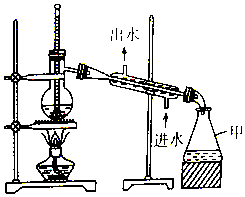
| A. | 仪器甲是锥形瓶,可直接用酒精灯加热 | |
| B. | 温度计水银球应该置于蒸馏烧瓶支管口处 | |
| C. | 直形冷凝管可用球形冷凝管代替 | |
| D. | 石油蒸馏时加沸石,制蒸馏水时不用加沸石 |
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
| A. | 乙酸乙酯的水解反应在碱性条件下比在酸性条件下水解更容易 | |
| B. | 油脂的水解可得到甘油,称为皂化反应 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 淀粉水解和纤维素水解得到的最终产物相同,它们是同分异构体 |
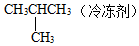
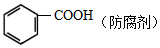 ⑥
⑥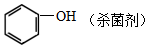
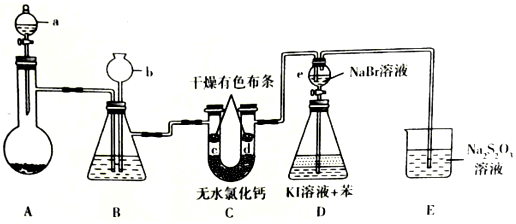
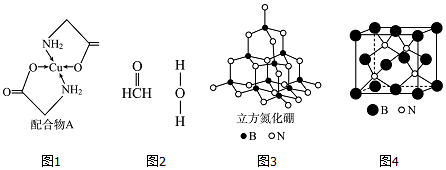
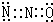 .
.