题目内容
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如图1:
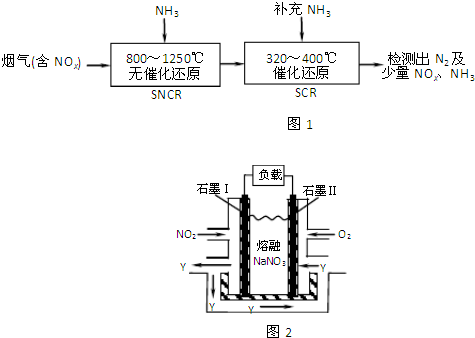
(1)反应2NO+2CO?2CO2+N2能够自发进行,则该反应的△H 0(填“>”或“<”).
(2)SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1;
6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H=-1807.0kJ?mol-1;
6NO2(g)+8NH3(g)?7N2(g)+12H2O(g)△H=-2659.9kJ?mol-1;
反应N2(g)+O2(g)?2NO(g)的△H= kJ?mol-1.
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图2.
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-.
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式: .
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气 L.

(1)反应2NO+2CO?2CO2+N2能够自发进行,则该反应的△H
(2)SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1;
6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H=-1807.0kJ?mol-1;
6NO2(g)+8NH3(g)?7N2(g)+12H2O(g)△H=-2659.9kJ?mol-1;
反应N2(g)+O2(g)?2NO(g)的△H=
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图2.
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-.
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式:
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气
考点:热化学方程式,化学电源新型电池
专题:基本概念与基本理论
分析:(1)依据反应自发进行的判断依据是△H-T△S<0,结合反应特征分析;
(2)依据热化学方程式和盖斯定律计算所需热化学方程式;
(3)以NO2、O2、熔融NaNO3组成的燃料电池,在使用过程中石墨I电极为原电池的负极,NO2被氧化,N元素混合升高,应生成N2O5,电极方程式为NO2+NO3--e-═N2O5,石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,以此解答该题;
(4)①Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,据此书写方程式;
②依据氧化还原反应、电解池电极反应的电子守恒计算分析;
(2)依据热化学方程式和盖斯定律计算所需热化学方程式;
(3)以NO2、O2、熔融NaNO3组成的燃料电池,在使用过程中石墨I电极为原电池的负极,NO2被氧化,N元素混合升高,应生成N2O5,电极方程式为NO2+NO3--e-═N2O5,石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,以此解答该题;
(4)①Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,据此书写方程式;
②依据氧化还原反应、电解池电极反应的电子守恒计算分析;
解答:
解:(1)反应2NO+2CO?2CO2+N2能够自发进行,△H-T△S<0,依据反应熵变△S<0可知,则该反应的△H<0;
故答案为:<;
(2)①4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1;
②6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H=-1807.0kJ?mol-1;
③6NO2(g)+8NH3(g)?7N2(g)+12H2O(g)△H=-2659.9kJ?mol-1;
依据盖斯定律①-②得到N2(g)+O2(g)?2NO(g)△H=+179.8kJ?mol-1;
故答案为:+179.8;
(3)以NO2、O2、熔融NaNO3组成的燃料电池,石墨I为原电池的负极,发生氧化反应,电极方程式为NO2+NO3--e-═N2O5;
故答案为:NO2+NO3--e-=N2O5;
(4)①Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,该电池工作时,用Fe为电极进行电解,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上是阳离子发生得电子的还原反应,即2H++2e-═H2↑,每处理100L Cr2O72-浓度为0.002mol/L废水,n(Cr2O72-)=100L×0.002mol/L=0.2mol,依据6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,电极反应Fe-2e-═Fe2+,O2+2N2O5+4e-═4NO3-,得到Cr2O72-~6Fe2+~12e-~3O2,消耗标准状况下氧气物质的量=0.2mol×3=0.6mol,标准状况体积=0.6mol×22.4L/mol=13.44L;
故答案为:13.44;
故答案为:<;
(2)①4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1;
②6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H=-1807.0kJ?mol-1;
③6NO2(g)+8NH3(g)?7N2(g)+12H2O(g)△H=-2659.9kJ?mol-1;
依据盖斯定律①-②得到N2(g)+O2(g)?2NO(g)△H=+179.8kJ?mol-1;
故答案为:+179.8;
(3)以NO2、O2、熔融NaNO3组成的燃料电池,石墨I为原电池的负极,发生氧化反应,电极方程式为NO2+NO3--e-═N2O5;
故答案为:NO2+NO3--e-=N2O5;
(4)①Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,该电池工作时,用Fe为电极进行电解,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上是阳离子发生得电子的还原反应,即2H++2e-═H2↑,每处理100L Cr2O72-浓度为0.002mol/L废水,n(Cr2O72-)=100L×0.002mol/L=0.2mol,依据6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,电极反应Fe-2e-═Fe2+,O2+2N2O5+4e-═4NO3-,得到Cr2O72-~6Fe2+~12e-~3O2,消耗标准状况下氧气物质的量=0.2mol×3=0.6mol,标准状况体积=0.6mol×22.4L/mol=13.44L;
故答案为:13.44;
点评:本题考查学生电解池的工作原理、氧化还原反应型离子方程式、热化学方程式的书写方法等知识,难度中等.

练习册系列答案
相关题目
市场上经常见到的标记为Li-ion的电池.它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料.这种锂离子电池的电池反应式为:Li+2Li0.35NiO2
2Li0.85NiO2,下列说法不正确的是( )
| 放点 |
| 充电 |
| A、放电时,负极的电极反应式:Li-e-=Li+ |
| B、充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C、该电池既能用酸溶液又能用碱溶液作电解质溶液 |
| D、放电过程中Li+向正极移动 |
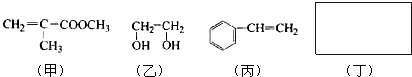
 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是