题目内容
下表是元素周期表的一部分
(1)在上述元素中,金属性最强的是 ,⑥~⑩中原子半径最小的是 (均填元素符号).
(2)表中元素⑩的氢化物的热稳定性比元素⑨的氢化物的热稳定性 (填“强”或“弱”).
(3)⑧号元素的最高价氧化物对应的水化物的化学式为 ,它与⑥号元素的最高价氧化物对应的水化物反应的离子方程式为 .
(4)下列结构图中,大黑点(●)代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点未用于形成共价键的最外层电子,短线代表共价键.
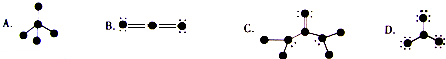
根据各图表示的结构特点,写出各分子的化学式:
A: ,B: ,C: ,D .
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)表中元素⑩的氢化物的热稳定性比元素⑨的氢化物的热稳定性
(3)⑧号元素的最高价氧化物对应的水化物的化学式为
(4)下列结构图中,大黑点(●)代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点未用于形成共价键的最外层电子,短线代表共价键.
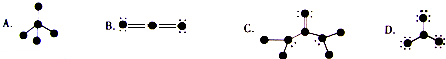
根据各图表示的结构特点,写出各分子的化学式:
A:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为Na、⑦为Mg、⑧为Al、⑨为S、⑩为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;同周期自左而右原子半径减小;
(2)同周期自左而右元素非金属性减弱,其氢化物稳定性减弱;
(3)⑧号元素的最高价氧化物对应的水化物为氢氧化铝,⑥号元素的最高价氧化物对应的水化物为氢氧化钠,二者反应生成偏铝酸钠与水;
(4)根据没有成键的电子数和成键电子数和推知原子的最外层电子数,根据原子序数小于10可知原子的种类,根据结构式可推知化学式.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;同周期自左而右原子半径减小;
(2)同周期自左而右元素非金属性减弱,其氢化物稳定性减弱;
(3)⑧号元素的最高价氧化物对应的水化物为氢氧化铝,⑥号元素的最高价氧化物对应的水化物为氢氧化钠,二者反应生成偏铝酸钠与水;
(4)根据没有成键的电子数和成键电子数和推知原子的最外层电子数,根据原子序数小于10可知原子的种类,根据结构式可推知化学式.
解答:
解:由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为Na、⑦为Mg、⑧为Al、⑨为S、⑩为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Na的金属性最强;同周期自左而右原子半径减小,故第三周期中Cl原子半径最小,
故答案为:Na;Cl;
(2)同周期自左而右元素非金属性减弱,其氢化物稳定性减弱,故氢化物稳定性:HCl>H2S,故答案为:强;
(3)⑧号元素的最高价氧化物对应的水化物为氢氧化铝,其化学式为Al(OH)3,⑥号元素的最高价氧化物对应的水化物为氢氧化钠,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(4)A.从A来看,中间原子形成4个共价键,没有电子剩余,则其最外层有4个电子,在1-10号元素中只有C,其余4个原子各只形成一个共价键,没有电子剩余,其最外层只有1个电子,故为H元素,所以A的化学式为CH4;
B.从B来看,中间原子形成2个双键,没有电子剩余,其最外层只有4个电子,为C元素,其余两边的原子形成2个共价键,剩余电子为4,则其最外层有,6个电子,在1-10号元素中只有O,故B的化学式为CO2;
C.中间原子形成4个共价键,没有电子剩余,则其最外层有4个电子,在1-10号元素中只有C,只与C原子形成2个共价键,且有4个剩余电子,该原子为O元素,与C原子形成1个共价键,且与另外原子又形成2个共价键,还剩余1对电子,该原子最外层电子数为5,故为N元素,与N原子相邻的原子只形成一个共价键,没有电子剩余,其最外层只有1个电子,故为H元素,所以C的化学式CO(NH2)2;
D.中间原子形成3个共价键,没有电子剩余,则其最外层有3个电子,在1-10号元素中只有B元素,其余原子形成1个共价键,还剩余3对电子,该原子最外层电子数为7,故为F元素,所以D的化学式BF3;
故答案为:CH4;CO2;CO(NH2)2;BF3.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Na的金属性最强;同周期自左而右原子半径减小,故第三周期中Cl原子半径最小,
故答案为:Na;Cl;
(2)同周期自左而右元素非金属性减弱,其氢化物稳定性减弱,故氢化物稳定性:HCl>H2S,故答案为:强;
(3)⑧号元素的最高价氧化物对应的水化物为氢氧化铝,其化学式为Al(OH)3,⑥号元素的最高价氧化物对应的水化物为氢氧化钠,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(4)A.从A来看,中间原子形成4个共价键,没有电子剩余,则其最外层有4个电子,在1-10号元素中只有C,其余4个原子各只形成一个共价键,没有电子剩余,其最外层只有1个电子,故为H元素,所以A的化学式为CH4;
B.从B来看,中间原子形成2个双键,没有电子剩余,其最外层只有4个电子,为C元素,其余两边的原子形成2个共价键,剩余电子为4,则其最外层有,6个电子,在1-10号元素中只有O,故B的化学式为CO2;
C.中间原子形成4个共价键,没有电子剩余,则其最外层有4个电子,在1-10号元素中只有C,只与C原子形成2个共价键,且有4个剩余电子,该原子为O元素,与C原子形成1个共价键,且与另外原子又形成2个共价键,还剩余1对电子,该原子最外层电子数为5,故为N元素,与N原子相邻的原子只形成一个共价键,没有电子剩余,其最外层只有1个电子,故为H元素,所以C的化学式CO(NH2)2;
D.中间原子形成3个共价键,没有电子剩余,则其最外层有3个电子,在1-10号元素中只有B元素,其余原子形成1个共价键,还剩余3对电子,该原子最外层电子数为7,故为F元素,所以D的化学式BF3;
故答案为:CH4;CO2;CO(NH2)2;BF3.
点评:本题考查元素周期表与元素周期律、共价键的形成、物质的推断,(4)中注意根据形成的共价键数目和孤电子对数判断原子的最外层电子数,以此推断元素的种类,难度中等.

练习册系列答案
相关题目
下列叙述或数据正确的是( )
| A、用广泛pH试纸测得某溶液的pH为2.3 |
| B、酸碱中和滴定实验中,锥形瓶必须用待测液润洗 |
| C、用已知浓度的盐酸滴定未知浓度的NaOH溶液时,若读取标准液读数时,滴前仰视,滴定到终点后俯视,会导致测定结果偏低 |
| D、用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL |
下列说法正确的是( )
| A、1mol氧含有6.02×1023个微粒 |
| B、阿伏加德罗常数数值约等于6.02×1023 |
| C、钠的摩尔质量等于它的相对原子质量 |
| D、1mol任何气体所含的气体分子数目,不一定都相等 |
一氧化碳是一种用途相当广泛的化工基础原料,利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)?Ni(CO)4(g)在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表:下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
| A、上述反应是熵增反应 |
| B、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol?L-1,则此时反应逆向进行 |
| C、25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 |
| D、恒温恒容,向达平衡的容器中再充入少量Ni(CO)4(g),达新平衡时,CO的百分含量将减小 |
 如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
 和
和 ;⑥
;⑥ 和
和 ;⑦
;⑦ 和
和  ;⑧CH3-CH2-CH=CH2 和CH2-CH=CH-CH2.
;⑧CH3-CH2-CH=CH2 和CH2-CH=CH-CH2.