题目内容
如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在③~⑦元素中,原子半径最小的是 ,其离子的原子结构示意图为 ;
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:
②的氢化物: ;③的过氧化物: ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,用离子方程式证明该事实(写出反应的离子方程式): ;
(5)用电子式表示①与氢气反应得到的化合物的形成过程 .
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是
(3)按要求写出下列两种物质的电子式:
②的氢化物:
(4)在⑦与⑩的单质中,化学性质较活泼的是
(5)用电子式表示①与氢气反应得到的化合物的形成过程
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:表中的①~⑩中元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br元素,
(1)同一周期元素,原子半径随着原子序数增大而减小,氯离子核外有3个电子层、最外层电子数是8;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素的金属性越强,其最高价氧化物的水化物碱性越强,呈两性的氢氧化物是Al(OH)3;
(3)②的氢化物是HF,HF分子中F原子和每个H原子之间共用一对电子;③的过氧化物是Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键;
(4)同一主族元素,元素的非金属性随着原子序数增大而减弱,其单质的氧化性随着原子序数增大而减弱,氯气和溴化物能发生置换反应;
(5)N原子和H原子通过共用电子对形成NH3.
(1)同一周期元素,原子半径随着原子序数增大而减小,氯离子核外有3个电子层、最外层电子数是8;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素的金属性越强,其最高价氧化物的水化物碱性越强,呈两性的氢氧化物是Al(OH)3;
(3)②的氢化物是HF,HF分子中F原子和每个H原子之间共用一对电子;③的过氧化物是Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键;
(4)同一主族元素,元素的非金属性随着原子序数增大而减弱,其单质的氧化性随着原子序数增大而减弱,氯气和溴化物能发生置换反应;
(5)N原子和H原子通过共用电子对形成NH3.
解答:
解:表中的①~⑩中元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br元素,
(1)同一周期元素,原子半径随着原子序数增大而减小,所以在③~⑦元素中,原子半径最小的是Cl原子,氯离子核外有3个电子层、最外层电子数是8,其离子结构示意图为 ,故答案为:Cl;
,故答案为:Cl; ;
;
(2)这几种元素中,非金属性最强的是F元素,但F没有正化合价,其次是Cl元素,所以酸性最强的酸是HClO4,金属性最强的金属是K,所以KOH的碱性最强,呈两性的氢氧化物是Al(OH)3,故答案为:HClO4;KOH;Al(OH)3;
(3)②的氢化物是HF,其电子式为 ;③的过氧化物是Na2O2,其电子式为
;③的过氧化物是Na2O2,其电子式为 ,故答案为:
,故答案为: ;
; ;
;
(4)同一主族元素,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强其单质的氧化性越强,所以化学性质较活泼的是Cl2,其单质的氧化性随着原子序数增大而减弱,氯气和溴化物能发生置换反应,反应为Cl2+2Br-=2Cl-+Br2,故答案为:Cl2;Cl2+2Br-=2Cl-+Br2;
(5)N原子和H原子通过共用电子对形成NH3,其形成过程为 ,故答案为:
,故答案为: .
.
(1)同一周期元素,原子半径随着原子序数增大而减小,所以在③~⑦元素中,原子半径最小的是Cl原子,氯离子核外有3个电子层、最外层电子数是8,其离子结构示意图为
 ,故答案为:Cl;
,故答案为:Cl; ;
;(2)这几种元素中,非金属性最强的是F元素,但F没有正化合价,其次是Cl元素,所以酸性最强的酸是HClO4,金属性最强的金属是K,所以KOH的碱性最强,呈两性的氢氧化物是Al(OH)3,故答案为:HClO4;KOH;Al(OH)3;
(3)②的氢化物是HF,其电子式为
 ;③的过氧化物是Na2O2,其电子式为
;③的过氧化物是Na2O2,其电子式为 ,故答案为:
,故答案为: ;
; ;
;(4)同一主族元素,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强其单质的氧化性越强,所以化学性质较活泼的是Cl2,其单质的氧化性随着原子序数增大而减弱,氯气和溴化物能发生置换反应,反应为Cl2+2Br-=2Cl-+Br2,故答案为:Cl2;Cl2+2Br-=2Cl-+Br2;
(5)N原子和H原子通过共用电子对形成NH3,其形成过程为
 ,故答案为:
,故答案为: .
.
点评:本题考查了元素周期表和元素周期律综合应用,涉及化学基本用语、氧化还原反应等知识点,根据物质结构、元素周期律等知识点分析解答即可,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、64g SO2中含有的氧原子数为2NA |
| B、含有6.02×1023个H原子的H2在标准状况下的体积约为22.4L |
| C、40g NaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol?L-1 |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
两种有机物以一定比例混合,一定条件下在a L O2(足量)中充分燃烧恢复到原状态,再通过过量的过氧化钠,得到气体仍是a L,下列组合中符合此条件的是( )
| A、CH4、C2H4 |
| B、CH3CH2OH、CH3COOH |
| C、C2H6、HCHO |
| D、HCOOH、CH3COOCH3 |
在某容积可变的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线.若试判断对图2的说法中正确的是( )


| A、P3>P4,y轴表示C的体积分数 |
| B、P3<P4,y轴表示B的质量分数 |
| C、P3<P4,y轴表示混合气体的密度 |
| D、P3>P4,y轴表示混合气体的平均摩尔质量 |
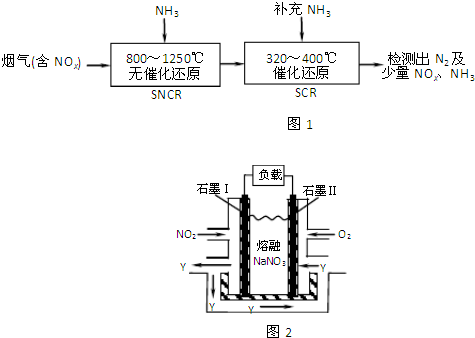
 某课外小组用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根
某课外小组用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根