题目内容
2.已知在25℃、1.013×105Pa下,16g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量,写出甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1.分析 n(CH4)=$\frac{16g}{16g/mol}$=1mol,则1molCH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量,结合焓变为负来解答.
解答 解:n(CH4)=$\frac{16g}{16g/mol}$=1mol,则1molCH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量,则甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意燃烧热的判断,题目难度不大.

练习册系列答案
相关题目
18.将SO2通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体后仍然无沉淀产生,此气体是( )
| A. | CO2 | B. | NH3 | C. | NO2 | D. | HCl |
16.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应; ②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应; ④过量的铜和浓硝酸在加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应;⑥过量的铜与浓硫酸在加热条件下反应.
①过量的锌与浓硫酸反应; ②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应; ④过量的铜和浓硝酸在加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应;⑥过量的铜与浓硫酸在加热条件下反应.
| A. | ②④⑥ | B. | ②⑤⑥ | C. | ②④⑤ | D. | ①②④⑥ |
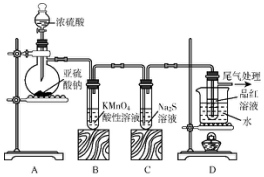
3.如图所示的是验证SO2性质的微型实验,a、b、c、d是浸有相关溶液的棉球.将硫酸滴入装有亚硫酸钠固体的培养皿.
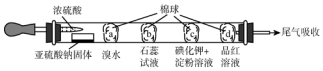
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )

关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )
| 选项 | 现象 | 解释和结论 |
| A | a处橙色褪去 | 还原性:Br->SO2 |
| B | b处先变为红色后褪色 | SO2能与H2O反应,且有漂白性 |
| C | c处变为蓝色 | SO2具有一定的氧化性 |
| D | d处红色褪去 | SO2具有漂泊性 |
| A. | A | B. | B | C. | C | D. | D |
7.依据下列实验操作及其实验现象得出的结论正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向溶有SO2 的BaC12 溶液中通入气体W | 有沉淀生成 | W一定是C12 |
| B | 待测液中加KSCN 溶液无明显现象,再滴入溴水 | 溶液变为红色 | 待测液中一定含Fe2+ |
| C | 蔗糖溶液中加入稀硫酸,加热片刻,冷却,滴入新制Cu ( OH )2悬浊液,加热 | 无红色沉淀 | 蔗糖未发生水解 |
| D | 常温下,擦亮的铝丝先放入浓硝酸中浸泡,然后放入CuSO4溶液中 | 铝丝表面无铜析出 | 铝与CuSO4溶液不反应 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验过程始终无明显现象的是( )
| A. | SO2通入BaCl2溶液中 | B. | CO2通入澄清石灰水中 | ||
| C. | NH3通入MgCl2溶液中 | D. | Cl2通入KI淀粉溶液中 |
11.构成氯化钠的微粒是( )
| A. | 氯离子和钠离子 | B. | 氯化钠分子 | ||
| C. | 氯原子和钠原子 | D. | 金属钠和非金属氯 |
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下NA个CH3CH2OH分子的体积约为22.4L | |
| B. | 1molCl2参加化学反应,转移的电子数一定为2NA | |
| C. | 23g14CO2与NO2的混合气体中,含O原子数、电子数分别为NA、11.5NA | |
| D. | 将标准状况下22.4L HCl气体通入1L、1mol/L的CH3COONa溶液,所得溶液中CH3COOH分子与CH3COO-离子的总数为NA |