题目内容
19.某化学兴趣小组为探究SO2的性质,按图的所示装置进行实验: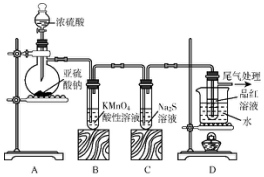
(1)装置A中盛放浓硫酸的仪器名称是蒸馏烧瓶,其中发生反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验过程中,装置B、C中发生的现象分别是溶液由紫红色变为无色、无色溶液中出现淡黄色浑浊,装置C中发生反应的化学方程式为2Na2S+SO2+2H2O=3S↓+4NaOH,实验结束后C中的试管如何洗涤,写出所用试剂热的氢氧化钠溶液
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)尾气可采用NaOH溶液吸收.
分析 装置A中盛放浓硫酸的仪器是分液漏斗,亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水,B中二氧化硫能使高锰酸钾溶液褪色,被氧化为硫酸,C中二氧化硫和硫化钠发生氧化还原反应生成硫,D中二氧化硫可使品红褪色,尾气可用氢氧化钠溶液处理,以此解答该题.
解答 解:(1)装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶,利用亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
故答案为:蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2Na2S+SO2+2H2O=3S↓+4NaOH,则观察到出现黄色浑浊,加热条件下,硫可与氢氧化钠溶液反应,则可用热的氢氧化钠溶液洗涤,
故答案为:溶液由紫红色变为无色;无色溶液中出现淡黄色浑浊;2Na2S+SO2+2H2O=3S↓+4NaOH;热的氢氧化钠溶液;
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)利用氢氧化钠溶液来吸收尾气,发生的离子反应为SO2+2OH-=SO32-+H2O,故答案为:NaOH.
点评 本题考查了二氧化硫的制取、二氧化硫的性质,为高频考点,综合性较强,明确实验原理是解本题关键,再结合物质的性质来分析解答,注意二氧化硫的漂白性和氯水漂白性的不同,二氧化硫虽然能使品红溶液褪色,但不能使酸碱指示剂褪色,为易错点,题目较简单.

 阅读快车系列答案
阅读快车系列答案| A. | 胆矾 | B. | 浓HNO3 | C. | AgBr | D. | HClO |
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 | |
| C. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是二氧化硫 | |
| D. | 浓H2SO4可以用铝制容器贮存,说明常温下铝与浓H2SO4不反应 |
| A. | SO3 | B. | NO2 | C. | FeCl3 | D. | Cu2S |
| A. | 防止爆炸事故发生 | B. | 防止吸潮结块,影响施肥 | ||
| C. | 防止生成难溶于水的物质 | D. | 防止因发生化学反应而跑氨 |
| 类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 生理盐水 | 纯碱 | 液态硝酸钾 | 蔗糖 |
| B | 氧化钙 | 海水 | 铜 | 乙醇 |
| C | 胆矾 | 氢氧化铁胶体 | 氯化银 | 二氧化碳 |
| D | 氢氧化钠 | 空气 | 硫酸钠溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |