题目内容
3.如图所示的是验证SO2性质的微型实验,a、b、c、d是浸有相关溶液的棉球.将硫酸滴入装有亚硫酸钠固体的培养皿.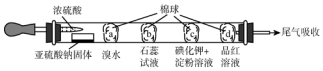
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )
| 选项 | 现象 | 解释和结论 |
| A | a处橙色褪去 | 还原性:Br->SO2 |
| B | b处先变为红色后褪色 | SO2能与H2O反应,且有漂白性 |
| C | c处变为蓝色 | SO2具有一定的氧化性 |
| D | d处红色褪去 | SO2具有漂泊性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.a处二氧化硫与溴水发生氧化还原反应;
B.b处二氧化硫与水反应生成亚硫酸;
C.c处溴与KI发生氧化还原反应;
D.d处品红溶液褪色.
解答 解:A.a处二氧化硫与溴水发生氧化还原反应,生成硫酸和HBr,可说明SO2的还原性较强,故A错误;
B.b处二氧化硫与水反应生成亚硫酸,为酸性物质,使石蕊变红,故B错误;
C.溴水易挥发,c处溴水与KI发生氧化还原反应,生成碘单质,淀粉变蓝,不能体现二氧化硫的氧化性,故C错误;
D.d处品红溶液褪色,则体现二氧化硫的漂白性,故D正确;
故选D.
点评 本题考查二氧化硫的性质,为高频考点,把握发生的反应及现象的分析为解答的关键,注意二氧化硫的还原性、漂白性,选项C为易错点,题目难度中等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
13.设NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 1mol氨基(-NH2)中含有电子数目为10NA | |
| C. | 一定条件下,1molN2和3molH2充分反应,转移电子数目为2NA | |
| D. | 常温下,1LPH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA |
14.对下列事实的解释正确的是( )
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 | |
| C. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是二氧化硫 | |
| D. | 浓H2SO4可以用铝制容器贮存,说明常温下铝与浓H2SO4不反应 |
11.在贮存和施用铵态氨肥时,都不能跟草木灰等碱性物质混和,原因是( )
| A. | 防止爆炸事故发生 | B. | 防止吸潮结块,影响施肥 | ||
| C. | 防止生成难溶于水的物质 | D. | 防止因发生化学反应而跑氨 |
18.亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂.当它只作氧化剂时,可能生成的产物是( )
| A. | NO2 | B. | N2 | C. | HNO3 | D. | NO |
9.某溶液中有NH4+、Fe3+、Fe2+ 和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中离子个数没有变化的离子是( )
| A. | NH4+ | B. | Fe3+ | C. | Fe2+ | D. | Al3+ |
6.氯气与水反应时,其中水( )
| A. | 是氧化剂 | B. | 既是氧化剂又是还原剂 | ||
| C. | 是还原剂 | D. | 既不是氧化剂,又不是还原剂 |
7.X(g)+2Y(s)?2Z(g)△H=-aKJ/mol,一定条件下,将1molX和2molY加入2L的恒容密闭容器中,10min后测得Y的物质的量为1.4mol.下列说法正确的是( )
| A. | 10min内,X的平均反应速率为0.03mol/(L•min) | |
| B. | 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态 | |
| C. | 10min后Z的浓度为0.7mol/L | |
| D. | 10min内,反应放出的热量为0.3aKJ |