题目内容
18.将SO2通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体后仍然无沉淀产生,此气体是( )| A. | CO2 | B. | NH3 | C. | NO2 | D. | HCl |
分析 将SO2通入BaCl2溶液中 如生成沉淀,应有两种情况,一是溶液中有较多的SO32-离子,或加入氧化性物质发生氧化还原反应将二氧化硫氧化生成SO42-离子,以此解答该题.
解答 解:A.通CO2仍不能反应,不会生成沉淀,故A选;
B.通入氨气溶液呈碱性,二氧化硫与氨水反应生成亚硫酸氨,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故B不选;
C.二氧化氮溶于水生成硝酸具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故C不选;
D.通HCl仍不能反应,不会生成沉淀,故D选;故选AD.
点评 本题考查了元素化合物知识,为高频考点,侧重考查二氧化硫的性质,特别是SO2的酸性、还原性的考查,把握发生的化学反应为解答的关键,注重基础知识夯实.

练习册系列答案
相关题目
13.自然界中存在着许多元素的循环,如图表示循环的元素是( )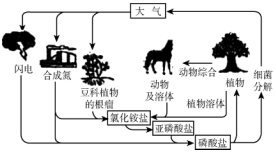

| A. | 氢 | B. | 碳 | C. | 氮 | D. | 硫 |
6.下列说法正确的是( )
| A. | 放热反应不需要加热,吸热反应需加热 | |
| B. | 物质发生化学变化必有能量变化 | |
| C. | 伴有能量的变化都是化学变化 | |
| D. | Na转化为Na+,吸收的能量就是该过程的反应热 |
13.设NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 1mol氨基(-NH2)中含有电子数目为10NA | |
| C. | 一定条件下,1molN2和3molH2充分反应,转移电子数目为2NA | |
| D. | 常温下,1LPH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA |
3.除去SO2中少量的SO3气体,应选用( )
| A. | 饱和碳酸氢钠溶液 | B. | 饱和亚硫酸钠溶液 | ||
| C. | 98.3%的浓硫酸 | D. | 氢氧化钠溶液 |
7.下列物质中不会因见光而分解的是( )
| A. | 胆矾 | B. | 浓HNO3 | C. | AgBr | D. | HClO |