题目内容
19.X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素的一种原子不含中子,Y元素在大气中存在两种常见单质,Z与X处于同一主族,W原子最外层电子数是次外层电子数的0.875倍.下列叙述正确的是( )| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
分析 X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素的一种原子不含中子,则X为H元素;Y元素在大气中存在两种常见单质,空气中含有氧气与臭氧,则Y为O元素;Z与X处于同一主族,则Z为Na;由原子序数可知W处于第三周期,W原子最外层电子数是次外层电子数的0.875倍,最外层电子数为8×0.875=7,故W为Cl.
解答 解:X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素的一种原子不含中子,则X为H元素;Y元素在大气中存在两种常见单质,空气中含有氧气与臭氧,则Y为O元素;Z与X处于同一主族,则Z为Na;由原子序数可知W处于第三周期,W原子最外层电子数是次外层电子数的0.875倍,最外层电子数为8×0.875=7,故W为Cl.
A.原子半径r(Na)>r(Cl)>r(O)>r(H),故A错误;
B.Y、W形成的最简单氢化物分别为H2O、HCl,水分子之间存在氢键,沸点高于HCl的,故B正确;
C.Na2O2中含有离子键、共价键,而H2O2中含有共价键,二者含有的化学键不完全相同,故C错误;
D.由O、Na、Cl三种元素组成的化合物可能为NaClO、NaClO4等,水溶液可能显中性,也可能先碱性,故D错误.
故选:B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律与元素化合物知识的掌握.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
9.化学与工农业生产和人类生活密切相关,下列说法正确的是( )
| A. | 光导纤维、氧化铝陶瓷、硅藻土都是无机非金属材料 | |
| B. | 节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物-光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物的原因是汽油燃烧不充分 | |
| D. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 |
7.下列说法错误的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | 乙酸的分子式为:C2H4O2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 比例模型 可以表示CO2 分子 可以表示CO2 分子 |
14.下列对有关化工生产的说法正确的是( )
| A. | 合成氨生产过程中将NH3液化分离,可以提高反应物的转化率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室 | |
| D. | 传统硅酸盐工业中生产水泥的原料为石灰石、纯碱和石英砂 |
4.下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O2、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物.
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O2、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物.
| A. | 只有①②④⑤ | B. | 只有①②⑤ | C. | 只有②⑤ | D. | 只有②④⑥ |
9.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18gH216O和20gH218O含有的质子数均为10NA | |
| B. | 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2═2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
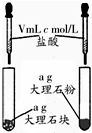
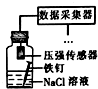
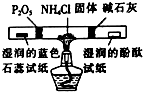
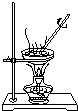
 如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:
如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题: