题目内容
10.下列相关实验不能达到目的是( )| A | B | C | D | |
| 相 关 实 验 |  |  |  |  |
| 目的 | 探究接触面积对反应速率的影响 | 判断铁钉的 腐蚀类型 | 检验NH4Cl的 分解产物 | 直接蒸干FeSO4饱和溶液制备无水FeSO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.固体表面积不同,反应速率不同;
B.如为析氢腐蚀,压强增大,如为吸氧腐蚀,压强减小;
C.氯化铵分解生成HCl和氨气,氨气可用碱石灰干燥,HCl可用五氧化二磷干燥,且氨气为碱性气体,可使红色石蕊试纸变蓝色;
D.蒸发时应防止温度过高而导致固体迸溅或变质.
解答 解:A.固体表面积不同,反应物的接触面积不同,则反应速率不同,可得到实验目的,故A正确;
B.如为析氢腐蚀,压强增大,如为吸氧腐蚀,压强减小,可用于检验腐蚀类型,故B正确;
C.氯化铵分解生成HCl和氨气,氨气可用碱石灰干燥,HCl可用五氧化二磷干燥,且氨气为碱性气体,可使红色石蕊试纸变蓝色,可完成氯化铵分解产物的检验,故C正确;
D.蒸发时应防止温度过高而导致固体迸溅或变质,不能直接蒸干,故D错误.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验原理及实验装置的作用为解答的关键,明确实验基本操作和物质的性质即可解答,注意实验的评价性和操作性分析,题目难度不大.

练习册系列答案
相关题目
20.有几种用途广泛的物质如表所示:
(1)按组成对上述物质分类,不涉及的物质类别是B
A.酸 B.碱 C.盐 D.氧化物
(2)高铁酸钾可存在于碱性环境中,在酸性环境下不稳定,发生如下反应:
4FeO42-+aH+=4Fe3++3R+cH2O R的化学式为O2,c=10
(3)Cu2O溶于稀硫酸,溶液变蓝色且有红色固体单质生成.写出发生该反应的离子方程式:Cu2O+2H+=Cu2++Cu+H2O
(4)化学上将一种阴离子和两种阳离子组成的盐叫复盐,如明矾.下列属于复盐的是C
A.Cu2(OH)2CO3 B.NH4H2PO4 C.(NH4)2Fe(SO4)2 D.Fe(OH)SO4
(5)草酸是一种弱酸,它是菠菜中营养成分之一.将酸性高锰酸钾溶液滴入草酸溶液中,振荡,溶液紫色消失生成Mn2+,并放出CO2气体.写出对应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++5CO2↑+8H2O.
| 化学式 | 名称或俗名 | 主要用途 |
| K2FeO4 | 高铁酸钾 | 高能材料、水处理剂和氧化剂 |
| H2C2O4 | 草酸 | 重要还原剂、菠菜成分之一 |
| KAl(SO4)2•12H2O | 明矾 | 净水剂、用于制油条和糕点 |
| Cu2O | 氧化亚铜 | 用于制红色涂料 |
A.酸 B.碱 C.盐 D.氧化物
(2)高铁酸钾可存在于碱性环境中,在酸性环境下不稳定,发生如下反应:
4FeO42-+aH+=4Fe3++3R+cH2O R的化学式为O2,c=10
(3)Cu2O溶于稀硫酸,溶液变蓝色且有红色固体单质生成.写出发生该反应的离子方程式:Cu2O+2H+=Cu2++Cu+H2O
(4)化学上将一种阴离子和两种阳离子组成的盐叫复盐,如明矾.下列属于复盐的是C
A.Cu2(OH)2CO3 B.NH4H2PO4 C.(NH4)2Fe(SO4)2 D.Fe(OH)SO4
(5)草酸是一种弱酸,它是菠菜中营养成分之一.将酸性高锰酸钾溶液滴入草酸溶液中,振荡,溶液紫色消失生成Mn2+,并放出CO2气体.写出对应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++5CO2↑+8H2O.
1. 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
Ⅰ.工业上最早射出碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:

(1)流程Ⅰ的另一种产物是HCl.
(2)流程Ⅱ的反应分步进行:a.Na2SO4+4C$\stackrel{1000℃}{=}$Na2S+4CO↑;b.Na2S与石灰石发生复分解反应,该工程总反应方程式为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+4CO↑+CaS.
Ⅱ.1862年,比利时人索尔维(Emesl Solvay)用氨碱法生产碳酸钠,反应原理如下:

20℃时一些物质在水中的溶解度如下表:
(3)除水外,氨醎法生产纯碱的原料还有石灰石、NH3和食盐,可循环利用的物质由CO2和NH3.
(4)饱和NaCl溶液通NH3和CO2能S生成NaHCO3的原因是反应体系中NaHCO3的溶解度最小.NH3和CO2应先通入的是NH3,原因是因为氨气的溶解度远大于CO2.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(5)生产中向已分离出NaHCO3晶体体后的溶液中加入适量NaCl固体并通入NH3,可以析出NH4Cl晶体.欲从溶液中充分分离该物质而不析出其他晶体,温度应控制在0~10℃.
 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.Ⅰ.工业上最早射出碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:

(1)流程Ⅰ的另一种产物是HCl.
(2)流程Ⅱ的反应分步进行:a.Na2SO4+4C$\stackrel{1000℃}{=}$Na2S+4CO↑;b.Na2S与石灰石发生复分解反应,该工程总反应方程式为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+4CO↑+CaS.
Ⅱ.1862年,比利时人索尔维(Emesl Solvay)用氨碱法生产碳酸钠,反应原理如下:

20℃时一些物质在水中的溶解度如下表:
| 物质 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| s/g | 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
(4)饱和NaCl溶液通NH3和CO2能S生成NaHCO3的原因是反应体系中NaHCO3的溶解度最小.NH3和CO2应先通入的是NH3,原因是因为氨气的溶解度远大于CO2.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(5)生产中向已分离出NaHCO3晶体体后的溶液中加入适量NaCl固体并通入NH3,可以析出NH4Cl晶体.欲从溶液中充分分离该物质而不析出其他晶体,温度应控制在0~10℃.
18.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成.放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究.
已知:①.NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-═Ni(OH)2+2OH-,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+.过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
已知:①.NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-═Ni(OH)2+2OH-,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+.过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
15.下列指定条件下描述正确的是( )
| A. | 石灰乳中通入Cl2制漂白精的离子反应方程式为:4OH-+2Ca2++2Cl2═2Cl-+Ca(ClO)2↓+2H2O | |
| B. | NaHCO3中滴入少量Ba(OH)2溶液,其离子方程式正确的是:H++CO32-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中H+、Fe2+、Cl-、SO42- 能大量共存 | |
| D. | pH=12的溶液中K+、Na+、CH3COO-、Br-能大量共存 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,11.2LNO2气体含有的分子数为 NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
19.X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素的一种原子不含中子,Y元素在大气中存在两种常见单质,Z与X处于同一主族,W原子最外层电子数是次外层电子数的0.875倍.下列叙述正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
20.化学与生产、生活 密切相关,背景材料:
①北大研制的石墨烯弹性气凝胶(又名碳海棉)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
①北大研制的石墨烯弹性气凝胶(又名碳海棉)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾有效措施 | |
| C. | 绚丽缤纷彩色的烟花中添加了含钾、钠、铁、铜等金属化合物 | |
| D. | 使用该分子催化剂可将一次能源太阳能直接转化成二次能源,例如电能、氢能 |
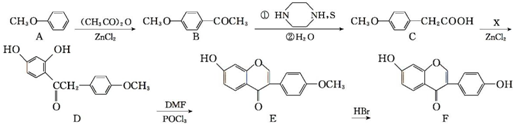
 ,写出该反应的化学方程式
,写出该反应的化学方程式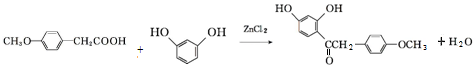 .
.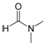 )在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N.
)在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N.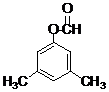 或
或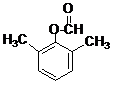 .(写出其中一种的结构简式)
.(写出其中一种的结构简式)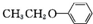 和(CH3CO)2O为原料制备
和(CH3CO)2O为原料制备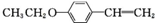 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: