题目内容
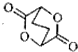
7.下列说法错误的是( )| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | 乙酸的分子式为:C2H4O2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 比例模型 可以表示CO2 分子 可以表示CO2 分子 |
分析 A、根据核素表示法结合质子数+中子数=质量数来判断;
B、乙酸是醋酸的俗称,属于饱和一元羧酸;
C、结构简式要体现官能团;
D、二氧化碳是直线型分子,碳原子半径大于氧原子.
解答 解:A、质子数+中子数=质量数,中子数为20的氯原子,质子数是17,质量数是37,故A正确;
B、乙酸是醋酸的俗称,属于饱和一元羧酸,分子式为:C2H4O2,故B正确;
C、结构简式要体现官能团,醛的结构简式:CH3CHO,故C错误;
D、二氧化碳是直线型分子,碳原子半径大于氧原子,比例模型可以表示为: ,故D正确.
,故D正确.
故选C.
点评 本题目涉及化学属于和物质的组成专题知识,属于基本知识的考查,难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
17.下列实验方案不合理的是( )
| A. | 鉴别葡萄糖溶液和淀粉溶液:加入新制的Cu(OH)2悬浊液加热或加碘水 | |
| B. | 鉴别织物成分是真丝还是人造丝:用灼烧的方法 | |
| C. | 鉴别淀粉溶液和蛋白质溶液:加入稀KI溶液 | |
| D. | 鉴别乙烷和乙烯:分别将气体通入溴水中 |
18.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成.放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究.
已知:①.NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-═Ni(OH)2+2OH-,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+.过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
已知:①.NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-═Ni(OH)2+2OH-,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+.过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
15.下列指定条件下描述正确的是( )
| A. | 石灰乳中通入Cl2制漂白精的离子反应方程式为:4OH-+2Ca2++2Cl2═2Cl-+Ca(ClO)2↓+2H2O | |
| B. | NaHCO3中滴入少量Ba(OH)2溶液,其离子方程式正确的是:H++CO32-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中H+、Fe2+、Cl-、SO42- 能大量共存 | |
| D. | pH=12的溶液中K+、Na+、CH3COO-、Br-能大量共存 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,11.2LNO2气体含有的分子数为 NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 15 g-CH3(甲基)含有中子数为6 NA | |
| B. | 5.6 g Fe粉完全溶于HCl和H2SO4的混合稀溶液,生成气体分子的数目为0.1 NA | |
| C. | 标准状况下,2.24 L NO2与N2O4的混合气体中含有氮原子的数目为0.1 NA | |
| D. | 在过氧化钠与CO2的反应中,每生成0.1 mol氧气,转移电子的数目为0.4 NA |
19.X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素的一种原子不含中子,Y元素在大气中存在两种常见单质,Z与X处于同一主族,W原子最外层电子数是次外层电子数的0.875倍.下列叙述正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
 ,其含氧官能团有肽键、醚键(写名称).
,其含氧官能团有肽键、醚键(写名称).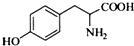 、
、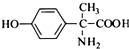 .
.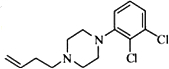 .
.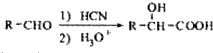 写出由C制备化合物
写出由C制备化合物