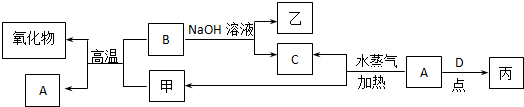
题目内容
室温时,0.1mol?L-1某一元酸HA在水中有0.1%发生电离,该溶液pH= ,此酸的电离平衡常数约为 ;由水电离出的c(H+)约为 .
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4;由HA?H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为
=1×10-7;
HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度.
| 10-4×10-4 |
| 0.1 |
HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度.
解答:
解:(1)HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故答案为:4;
(2)由HA?H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为Ka=
=1×10-7,故答案为:1×10-7;
(3)HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢氧根离子为
mol/L=10-10mol/L,而水电离氢离子浓度等于氢氧根离子的浓度,即由水电离出的c(H+)=10-10mol/L,故答案为:10-10mol/L.
(2)由HA?H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为Ka=
| 10-4×10-4 |
| 0.1 |
(3)HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢氧根离子为
| 10-14 |
| 10-4 |
点评:本题考查弱酸的电离,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,难度不大.

练习册系列答案
相关题目
 毒豇豆、毒黄瓜等毒蔬菜中含有禁用农药水胺硫磷,水胺硫磷的结构简式如图所示,对该化合物的叙述正确的是( )
毒豇豆、毒黄瓜等毒蔬菜中含有禁用农药水胺硫磷,水胺硫磷的结构简式如图所示,对该化合物的叙述正确的是( )| A、该化合物属于芳香烃 |
| B、该化合物中至少有7个碳原子在同一平面 |
| C、该化合物的分子式为C11H14O4NPS |
| D、该化合物能发生加聚反应、水解反应和酯化反应 |
对于实验的描述正确的是( )
A、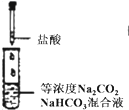 逐滴滴加稀盐酸时,试管中立即产生大量气泡 |
B、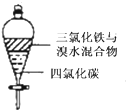 充分振荡后静置,下层溶液为橙红色,上层无色 |
C、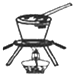 从饱和食盐水中提取NaCl晶体 |
D、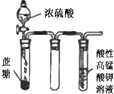 酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
一定条件下,在四个恒定密闭容器中分别进行下列反应,其中依据“容器内气体压强不变”可判定该反应达到平衡状态的是( )
| A、CO2(g)+H2(g)?CO(g)+H2O(g) |
| B、C(s)+CO2(g)?2CO(g) |
| C、2HI(g)?H2(g)+I2(g) |
| D、FeO(s)+CO(g)?Fe(s)+CO2(g) |
标准状况下,某气态有机物密度为3.125g/L,则该有机物的最简式可能是( )
| A、CH |
| B、CH2 |
| C、CH3 |
| D、CH2O |