题目内容
12.ClO2与Cl2的氧化性相近,常温下均为气体,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
(1)仪器C的名称是:球形干燥管.安装F中导管时,应选用图2中的:b(填“a”或“b”)
(2)打开B的活塞,A中氯酸钠和稀盐酸混和产生Cl2和ClO2,写出反应化学方程式:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;为使ClO2在D中被稳定剂充分吸收,可采取的措施是调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度.
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是:吸收Cl2.
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是:检验是否有ClO2生成.
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂的保鲜原因是:稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
分析 (1)由图可知仪器的名称,F装置应是Cl2和KI反应,还需要连接尾气处理装置,导管要长进短出;
(2)A中氯酸钠和稀盐酸混和产生Cl2和ClO2,为使ClO2在D中被稳定剂充分吸收,可减缓反应速率;
(3)ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,可知C中吸收氯气;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,以此书写离子反应方程式;ClO2在D中被稳定剂完全吸收生成NaClO2,F可检验是否有ClO2生成;
(5)由图可知,稳定剂Ⅱ保鲜时间长.
解答 解:(1)根据仪器特征,可知仪器C是球形干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,
故答案为:球形干燥管;b;
(2)氯酸钠和稀盐酸混和产生Cl2和ClO2,NaClO3中氯为+5价被还原成ClO2中+4价,盐酸中氯为-1价,被氧化成0价氯,转移电子数为2,所以NaClO3、ClO2前系数为2,Cl2前系数为1,反应化学方程式为2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,即调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度,
故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,
故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;检验是否有ClO2生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,
故答案为:稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题考查物质的制备实验,为高频考点,把握物质的性质、制备原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的应用,题目难度不大.

| A. | 绿矾一FeSO4•7H2O | B. | 芒硝一Na2SO4•10H2O | ||
| C. | 明矾一Al(SO4)3•12H2O | D. | 胆矾一CuSO4•5H2O |
| A. | 氢氧化钠溶液 | B. | 食盐水 | C. | 浓硫酸 | D. | 盐酸 |
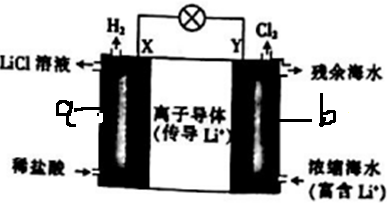
| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+206.1kJ•mol-1
③焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ•mol-1 .
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ba(OH)2溶液与H2SO4溶液反应:Ba2++2H++2OH-+SO42-═BaSO4↓+2H2O | |
| C. | Na2CO3溶液与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NH4Cl 溶液显酸性:NH4++H2O?NH3•H2O+H+ |
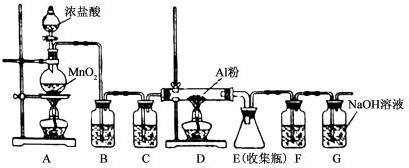
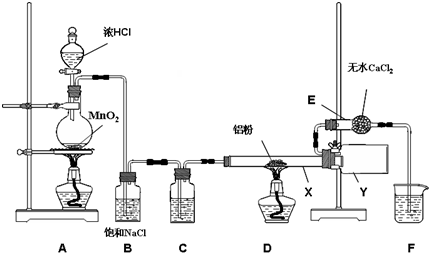
 2AlCl3
2AlCl3