题目内容
7.浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓度差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法不正确的是( )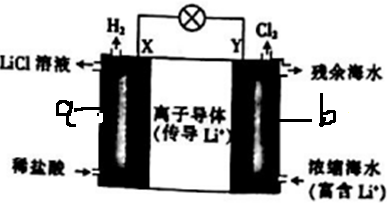
| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
分析 加入稀盐酸,在X极(正极)上生成氢气,发生还原反应,电极方程式为2H++2e-═H2↑,为正极反应,Y极生成Cl2,为负极反应,发生2Cl--2e-=Cl2↑,原电池中电流从正极流向负极,阳离子向正极移动,以此解答该题.
解答 解:A.电池工作时,Li+向正极a上移动,故A错误;
B.生成氯气的Y极发生氧化反应,为负极,电子由Y极通过外电路移向X极,故B错误;
C.在X极(正极)上生成氢气,发生还原反应,电极方程式为2H++2e-═H2↑,故C正确;
D.Y极每生成1 mol Cl2,则转移2mol电子,有2molLi+向正极移动,则a区得到2 mol LiCl,故D正确.
故选AB.
点评 本题考查原电池的工作原理,为高频考点,把握总反应式结合物质所含元素化合价的变化判断原电池的正负极、电极方程式的书写方法为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
相关题目
19.化学与生活、生产、环境等密切相关.下列叙述不正确的是( )
| A. | 可用聚氯乙烯代替乙烯制作食品包装袋 | |
| B. | 去除银器表面Ag2S,可将银器放在盛有食醋的铝锅中煮沸片刻 | |
| C. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都符合环保理念 | |
| D. | “连续纤维增韧”航空材料主要是由碳化硅、陶瓷和碳纤维复合而成,是一种新型无机非金属材料 |
2. 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )| A. | 从N→M:先向N中加入适量固体A再降温 | |
| B. | 从N→M:先将N降温再加入适量固体A | |
| C. | 从M→N:先将M降温再将其升温 | |
| D. | 从M→N:先将M升温再将其蒸发掉部分水 |
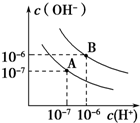 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:
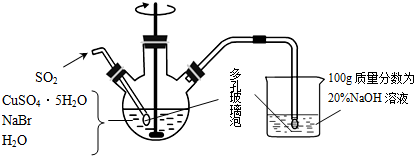

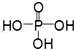 )
)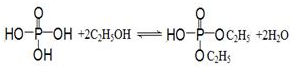 .
. .
.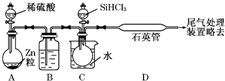 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: