题目内容
2.无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃但在180℃时已开始升华.它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水气也强烈地发烟.用下列装置制取无水氯化铝,回答以下问题: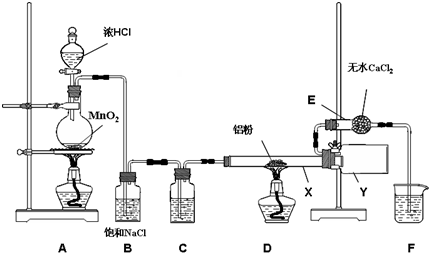
(1)装置D 中发生的化学反应方程式2Al+3Cl2
 2AlCl3
2AlCl3(2)仪器X与仪器Y 直接相连的意图是:①收集产物 ②防止堵塞,
(3)能否去掉E 装置不能,原因是防止E中水气与AlCl3作用,
(4)实验时应先点燃A处的酒精灯,其作用是用氯气排尽装置中的空气以防产品不纯
(5)写出铝粉与过量NaOH溶液反应的离子反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑检验上述反应所得含氧酸根的方法(简述实验操作及现象)逐滴滴加盐酸至过量先出现白色沉淀后沉淀消失.
分析 无水氯化铝制备实验中,特别注意三氯化铝极易水解的性质及偏铝酸根离子的检验.
(1)装置D中铝粉与氯气反应生成三氯化铝;
(2)无水氯化铝在180℃时已开始升华,生成的氯化铝以气态形式进入Y装置,然后凝结为固体;
(3)无水氯化铝遇水发生剧烈的水解反应,所以要防止水蒸气进入Y装置,因此不能去掉E装置;
(4)实验装置中有空气,空气中的氧气能与铝粉反应,所以加热前先通氯气把装置中的氧气排尽;
(5)铝粉与过量NaOH溶液反应生成氢气和偏铝酸根离子,检验偏铝酸根离子的方法是逐滴滴加盐酸至过量 先出现白色沉淀后沉淀消失.
解答 解:(1)装置D中铝粉与氯气反应生成三氯化铝,反应方程式为:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3;故答案为:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3;
(2)无水氯化铝在180℃时已开始升华,生成的氯化铝以气态形式进入Y装置,然后凝结为固体,所以仪器X与仪器Y直接相连的目的是收集产物、防止堵塞;故答案为:防止堵塞;
(3)无水氯化铝遇水发生剧烈的水解反应,所以要防止水蒸气进入Y装置,因此不能去掉E装置,故答案为:不能;防止E中水汽与AlCl3作用;
(4)实验装置中有空气,空气中的氧气能与铝粉反应,所以加热前先通氯气把装置中的氧气排尽,所以先点燃A制取氯气,故答案为:A;用氯气排尽装置中的空气以防产品不纯;
(5)铝粉与过量NaOH溶液反应生成氢气和偏铝酸根离子,反应的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,检验偏铝酸根离子的方法是逐滴滴加盐酸至过量 先出现白色沉淀后沉淀消失,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;逐滴滴加盐酸至过量,先出现白色沉淀后沉淀消失.
点评 本题考查对实验原理的理解与实验操作评价、离子检验,物质的制备.理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识,难度中等.

| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 三氯化铁溶液跟过量氨水反应Fe3++3OH-═Fe(OH)3↓ |

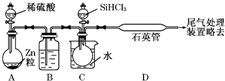 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
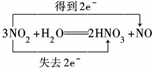 .
.