题目内容
氯气是一种重要的化工原料,在生产和生活中的应用十分广泛.
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式.
(2)实验室欲制得氯气1.12L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36L 氯气与4.0mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是 .
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式.
(2)实验室欲制得氯气1.12L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36L 氯气与4.0mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
考点:氯气的化学性质
专题:卤族元素
分析:(1)浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水;
(2)根据反应方程式:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O进行计算;
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,根据方程式计算氯气和氢氧化钠的量之间的关系;随着反应的进行,浓盐酸的浓度变小,但是二氧化锰和稀盐酸之间不反应.
(2)根据反应方程式:MnO2+4HCl(浓)
| ||
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,根据方程式计算氯气和氢氧化钠的量之间的关系;随着反应的进行,浓盐酸的浓度变小,但是二氧化锰和稀盐酸之间不反应.
解答:
解:(1)浓盐酸与二氧化锰加热反应来制取氯气的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)根据反应方程式:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,制得氯气1.12L即0.05mol,理论上需要消耗二氧化锰0.05mol,质量是0.05mol×87g/mol=4.35g,答:理论上需要消耗二氧化锰4.35克;
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+2NaOH=NaCl+NaClO+H2O,3.36L氯气在标况下的物质的量是0.15mol,消耗氢氧化钠是0.3mol,NaOH溶液的体积是
=0.075L=75mL,
答:需要75mL这种NaOH溶液能与氯气恰好完全反应;
②随着反应的进行,浓盐酸的浓度变小,但是二氧化锰和稀盐酸之间不反应,所以反应产物的质量明显小于理论值,故答案为:随着反应的进行,浓盐酸的浓度变小,但是二氧化锰和稀盐酸之间不反应.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)根据反应方程式:MnO2+4HCl(浓)
| ||
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+2NaOH=NaCl+NaClO+H2O,3.36L氯气在标况下的物质的量是0.15mol,消耗氢氧化钠是0.3mol,NaOH溶液的体积是
| 0.3mol |
| 4mol/L |
答:需要75mL这种NaOH溶液能与氯气恰好完全反应;
②随着反应的进行,浓盐酸的浓度变小,但是二氧化锰和稀盐酸之间不反应,所以反应产物的质量明显小于理论值,故答案为:随着反应的进行,浓盐酸的浓度变小,但是二氧化锰和稀盐酸之间不反应.
点评:本题考查氯气的性质与实验室制备原理以及根据方程式的计算等知识,难度中等.

练习册系列答案
相关题目
除去乙烷中混有少量乙烯的最好试剂是( )
| A、酸性KMnO4溶液 |
| B、催化剂加氢 |
| C、溴的四氯化碳溶液 |
| D、溴水 |
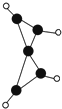 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )| A、充分燃烧等质量的X和甲烷,X消耗氧气较多 |
| B、X是一种常温下能稳定存在的液态烃 |
| C、X和乙烷类似,都容易发生取代反应 |
| D、X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色 |
下列各组物质中,属于同分异构体的是( )
| A、CH3CHCH2CH2CH3CH3和CH3CHCH2CH2CH2CH3CH3 |
| B、H2N-CH2-COOH和H3C-CH2-NO2 |
| C、CH3-CH2-CH2-COOH和H3C-CH2-CH2-CH2-COOH |
| D、H3C-CH2-O-CH2-CH3和CH3CHCH3CH3 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色,再向反应后的溶液中通入过量的SO2气体,溶液变成无色.则下列说法正确的是( )
| A、通入22.4L SO2参加反应时,有2NA个电子发生转移 |
| B、通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C、滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| D、上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32-、 |
| B、c(H+)=1×10-13 mol?L-1的溶液中:Mg2+、Cu2+、NO3- |
| C、0.1 mol?L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、0.1 mol?L-1FeCl3溶液中:Fe2+、SCN-、SO42- |
下列对各组物质性质的比较中,正确的是( )
| A、第一电离能:Na<Mg<Al |
| B、熔点:金刚石>晶体硅>碳化硅 |
| C、硬度:Li>Na>K |
| D、热稳定性:HF、HCl、HBr、HI依次增强 |