题目内容
12.关于如图装置中的变化叙述错误的是( )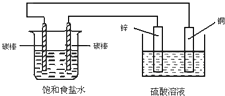
| A. | 电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片 | |
| B. | 铜片上发生氧化反应 | |
| C. | 右侧碳棒上发生的反应:2H++2e→H2↑ | |
| D. | 铜电极出现气泡 |
分析 右边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,再结合原电池和电解池原理解答.
解答 解:边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,
A.电子从负极锌沿导线流向右侧碳棒,再从左侧碳棒流回正极铜片,故A正确;
B.锌片上失电子发生氧化反应,铜片上发生还原反应,故B产物;
C.左侧碳棒是电解池阳极,阳极上应该是氯离子放电生成氯气,右侧碳棒是阴极,该电极上发生的反应:2H++2e→H2↑,故C正确;
D.铜电极是正极,正极上氢离子得电子析出氢气,故D正确;
故选B.
点评 本题考查原电池和电解池原理,正确判断原电池和电解池是解本题关键,难度不大,注意电子不进入电解质溶液,为易错点.

练习册系列答案
相关题目
2.为了改善空气质量,下列措施不合理的是( )
| A. | 倡导绿色化学理念,努力实现“原子经济” | |
| B. | 控制城市机动车保有量,实行机动车限号行驶 | |
| C. | 淘汰落后产能,将污染严重的企业从城市迁往农村 | |
| D. | 减少化石能源的使用,大力发展太阳能、风能等新能源 |
3.在铁质品上镀上一定厚度的锌层,以下电镀方案正确的是( )
| A. | 锌作阳极,铁制品作阴极,溶液中含Zn2+ | |
| B. | 锌作阳极,铁制品作阴极,溶液中含Fe3+ | |
| C. | 锌作阴极,铁制品作阳极,溶液中含Zn2+ | |
| D. | 锌作阴极,铁制品作阳极,溶液中含Fe3+ |
7.下列物质分类正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 多肽、油脂、淀粉均为酯类 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 福尔马林、漂粉精、氨水均为混合物 |
17.能正确表示下列反应的离子反应方程式为( )
| A. | NH4HCO3稀溶液与过量的KOH溶液反应:NH4++HCO3-+2OH-→CO32-+NH3•H2O+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-→2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2→2 Fe3++2 Br2+6 Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3→Ca2++CO2↑+H2O |
1.下列实验操作能达到目的是( )
| A. | 锅炉水垢用饱和纯碱溶液浸泡,即可除去 | |
| B. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解完全 | |
| C. | 向C2H5X消去反应后的溶液中滴加硝酸银溶液,即可检验卤原子X的种类 | |
| D. | 将25 g CuSO4•5H2O溶于100 mL水中,可配得100 mL1.0 mol/L CuSO4溶液 |

 .
.