题目内容
12.NaOH溶液导电的原因是含有( )| A. | 自由移动的分子 | B. | 自由移动的离子 | C. | 自由移动的电子 | D. | 自由移动的原子 |
分析 含有自由移动离子或电子的物质能导电,据此分析解答.
解答 解:含有自由移动离子或电子的物质能导电,NaOH在水分子的作用下电离出自由移动阴阳离子而使NaOH溶液导电,故选B.
点评 本题考查电解质导电原理,侧重考查学生分析判断能力,注意电解质与导电的关系,知道电解质不一定导电、导电的不一定是电解质,知道电解质在水溶液中发生电离不需要通电,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
3.关于维生素C的说法中不正确的是( )
| A. | 易溶于水,水溶液显酸性 | B. | 受热易被氧化 | ||
| C. | 在水溶液中容易被还原 | D. | 新鲜的水果和蔬菜中含有维生素C |
20.高铁酸钠是一种新型、高效、多功能水处理剂,高铁酸钠(Na2FeO4)制备方法有:
湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移4 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
7.下列现象或新技术应用中,不涉及胶体性质的是( )
| A. | 在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光柱 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
17.下列含氯化合物中,不能由金属单质和氯气直接反应得到的是( )
| A. | FeCl2 | B. | CuCl2 | C. | AlCl3 | D. | AgCl |
4.据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH?CH3CHO;已知△H<0.据此你认为下列说法中正确的是( )
| A. | 该星球表面温度很高 | |
| B. | 该星球表面温度很低 | |
| C. | 低温下稳定性CH2=CHOH>CH3CHO | |
| D. | 该反应中CH2=CHOH化学键断裂吸收能量大于CH3CHO化学键形成放出能量 |
1.电解质溶液的电导率越大,导电能力越强.用0.1mol•L-1的NaOH溶液分别滴定体积均为10.00mL浓度均为0.1mol•L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )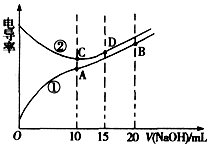

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol.L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
2.在相同条件下,下面各组热化学方程式中,△H1>△H 2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H1 2H2(g)+O2(g)=2H2O(g);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | H2(g)+Cl2(g)=2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 | |
| D. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 |
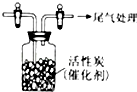 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.