题目内容
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g)②2HI(g)?H2(g)+I2(g),达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下NH3的平衡浓度为( )
①NH4I(s)?NH3(g)+HI(g)②2HI(g)?H2(g)+I2(g),达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下NH3的平衡浓度为( )
| A、0.5 | B、1 | C、4 | D、5 |
考点:化学平衡的计算
专题:化学平衡专题
分析:NH4I分解出的HI为平衡与已分解的之和,即为NH4I分解出的NH3物质的量浓度,I2来自HI的分解,根据I2为0.5摩/升可知,HI分解的浓度,进而计算NH3的浓度.
解答:
解:反应达到平衡时[H2]=0.5mol/L,根据2HI(气)?H2(气)+I2(气)可知,HI分解的浓度为2×0.5mol/L=1mol/L,
反应达到平衡时[HI]=4mol/L,所以平衡时NH3的浓度[NH3]=4mol/L+1mol/L=5mol/L.
故选D.
反应达到平衡时[HI]=4mol/L,所以平衡时NH3的浓度[NH3]=4mol/L+1mol/L=5mol/L.
故选D.
点评:本题考查化学平衡的计算,解题关键在于明白NH4I分解出的HI为平衡与已分解的之和,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将a g铁和氧化铁的混合物加入800mL pH=1的盐酸中充分反应后,固体无剩余,盐酸全部消耗,放出标准状况下气体 0.224L.则下列判断中正确的是( )
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入无色的KSCN溶液,显血红色 |
| C、无法计算出原混合物的质量 |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
共价键、离子键、金属键、分子间作用力都是微粒间的作用力,含有以上两种作用力的晶体是( )
| A、HCl | B、金刚石 |
| C、NaOH | D、Na |
A、B、C、D 为4种金属.将A、B分别加入等浓度稀盐酸中,B比A反应更剧烈.将A、D用导线连结,同时浸入稀硫酸中,D表面出现大量气泡.将D浸入C的盐溶液中,有C析出.则其金属活动性由强到弱的顺序是( )
| A、B>A>D>C |
| B、A>B>D>C |
| C、B>A>C>D |
| D、C>D>A>B |
根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,下列说法正确的是( )
| A、1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和 |
| B、1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和 |
| C、S(g)+O2(g)=SO2(g)△H=-Q kJ/mol; Q的值大于297.23 |
| D、S(g)+O2(g)=SO2(g)△H=-Q kJ/mol; Q的值等于297.23 |
下列实验方案设计合理且能达到相应实验预期目的是( )
A、 制取少量蒸馏水 |
B、 用铜和浓硝酸制取少量NO2 |
C、 证明氧化性:Cl2>Br2>I2 |
D、 制取HCL且除去多余的气体 |
下列有关实验操作正确的是( )
A、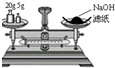 称量氢氧化钠固体 |
B、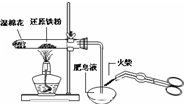 检验铁粉与水蒸气反应产生的氢气 |
C、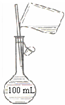 配制150 mL 0.10 mol/L盐酸 |
D、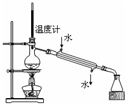 分离两种互溶但沸点相差较大的液体混合物 |
目前人们正研究开发一种高能电池--钠硫电池,它以熔融的钠、硫为两极,以Na+导电的β″Al2O3陶瓷作固体电解质,反应为2Na+xS
Na2Sx.以下说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,硫作负极,电极反应式为:xS+2e-=Sx2- |
| B、放电时,电池中消耗4.6g Na,反应中转移1.204×1023个电子 |
| C、该反应一定是一个自发进行的吸热反应 |
| D、放电时,电子从钠极经外电路流向到硫极,再从硫极经内电路流向钠 |
将钠加入到下列溶液中,既产生气体又产生沉淀的是( )
| A、CuCl2 |
| B、Na2SO4 |
| C、MgCl2 |
| D、KNO3 |