题目内容
常温下,将HCl溶液和一元碱AOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明AOH是强碱还是弱碱 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.1 (选填“是”或“否”).
(3)丙组实验所得溶液中由水电离出的c(OH-)= mol?L-1.
| 实验编号 | HCl物质的量浓度(mol?L-1) | AOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.1 | c | pH=7 |
| 丙 | 0.1 | 0.1 | pH=5 |
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.1
(3)丙组实验所得溶液中由水电离出的c(OH-)=
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)酸碱恰好完全反应,如反应后呈中性,则pH=7,为强碱,如pH<7,则为弱碱;
(2)若AOH为强碱,则c等于0.1,若AOH为弱碱,则c大于0.1,所以c不一定为0.1;
(3)所得混合溶液为浓度为0.05mol/L的ACl溶液,其pH为5,促进水的电离,H+全部为水电离的,以此可计算浓度.
(2)若AOH为强碱,则c等于0.1,若AOH为弱碱,则c大于0.1,所以c不一定为0.1;
(3)所得混合溶液为浓度为0.05mol/L的ACl溶液,其pH为5,促进水的电离,H+全部为水电离的,以此可计算浓度.
解答:
解:(1)不考虑其它组的实验结果,单从甲组情况分析,a=7,AOH为强碱;a<7,AOH为弱碱,
故答案为:若a=7,AOH为强碱;a<7,AOH为弱碱;
(2)不考虑其它组的实验结果,单从乙组情况分析,pH=7,若AOH为强碱,则c等于0.1,若AOH为弱碱,则c大于0.1,所以c不一定为0.2,
故答案为:否;
(3)丙组实验所得混合溶液为浓度为0.05mol/L的ACl溶液,其pH=5,促进了水的电离,H+全部为水电离的,所以由水电离出的c(OH-)=10-5mol/L,
故答案为:10-5 .
故答案为:若a=7,AOH为强碱;a<7,AOH为弱碱;
(2)不考虑其它组的实验结果,单从乙组情况分析,pH=7,若AOH为强碱,则c等于0.1,若AOH为弱碱,则c大于0.1,所以c不一定为0.2,
故答案为:否;
(3)丙组实验所得混合溶液为浓度为0.05mol/L的ACl溶液,其pH=5,促进了水的电离,H+全部为水电离的,所以由水电离出的c(OH-)=10-5mol/L,
故答案为:10-5 .
点评:本题考查较为综合,涉及了盐类水解、强弱酸、电荷守恒等知识,有一定的综合性,为高考常见题型,侧重于学生的分析能力和计算能力的考查,该题的命题方式为高考命题的热点,本题难度适中.

练习册系列答案
相关题目
区别植物油和矿物油的不正确方法是( )
| A、加酸性KMnO4溶液、振荡 |
| B、加NaOH溶液、煮沸 |
| C、加新制碱性Cu(OH)2悬浊液、煮沸 |
| D、加Br2水、振荡 |
能用于鉴别淀粉、肥皂和蛋白质三种溶液的试剂是( )
| A、碘水 | B、硫酸镁溶液 |
| C、烧碱溶液 | D、浓硝酸 |
下列化学用语书写正确的是( )
A、甲烷的电子式: |
| B、乙醛的结构简式:CH3COH |
| C、乙烯的结构式:CH2=CH2 |
D、乙醇的结构式: |
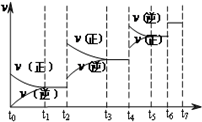 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)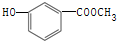 中含有的官能团的名称为:酚羟基和
中含有的官能团的名称为:酚羟基和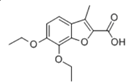 的分子式可用C14HyO5表示,y=
的分子式可用C14HyO5表示,y= B.
B.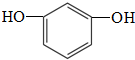 C.
C.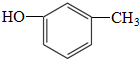 .
.