题目内容
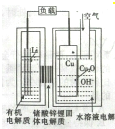
 铝表面空气中天然形成的氧化膜耐磨性和抗蚀性不够强,控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬的氧化膜.下列有关叙述正确的是( )
铝表面空气中天然形成的氧化膜耐磨性和抗蚀性不够强,控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬的氧化膜.下列有关叙述正确的是( )| A、阴极上有金属铝生成 |
| B、电极A为石墨,电极B为金属铝 |
| C、OH-在电极A上放电,有氧气生成 |
| D、阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据原电池装置和题目信息可知电解总反应为:2Al+3H2O
Al2O3+H2↑,电解质为硫酸溶液,氢氧根离子不可能参加反应,阳极反应为:2Al+3H2O-6e-=Al2O3+6H+,阴极反应为:2H+-2e-=H2↑,据此分析.
| ||
解答:
解:A、阴极反应为:2H+-2e-=H2↑,故A错误;
B、电极A为Al,故B错误;
C、电解质为硫酸溶液,氢氧根离子不可能参加反应,阳极反应为:2Al+3H2O-6e-=Al2O3+6H+,故C错误;
D、阳极反应为:2Al+3H2O-6e-=Al2O3+6H+,故D正确;
故选D
B、电极A为Al,故B错误;
C、电解质为硫酸溶液,氢氧根离子不可能参加反应,阳极反应为:2Al+3H2O-6e-=Al2O3+6H+,故C错误;
D、阳极反应为:2Al+3H2O-6e-=Al2O3+6H+,故D正确;
故选D
点评:本题考查了电解池的相关知识,注意电解液的酸碱性对反应的影响,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列说法正确的是( )
| A、向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大 |
| B、某溶液中由水电离出的c(H+)=1.0×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液中:c(R2-)+c(HR-)=c(Na+) |
| D、相同物质的量浓度的①NH4Al(SO4)2 ②NH4Cl③CH3COONH4 ④NH3?H2O溶液中,c(NH4+)由大到小的顺序是:①>②>③>④ |
已知O4是氧元素的一种新的单质,它具有强氧化性,能将Fe2+氧化为Fe3+,其方程式为 O4+Fe2++-Fe3++H2O+O2 (未配平).下列说法正确的是( )
| A、O4和O2是同种物质,都大量存在于空气中 |
| B、该反应需要在酸性条件下进行 |
| C、每生成22.4L O2将转移4NA个电子 |
| D、64gO4和O2的混合气体所含有的分子数为2NA |
 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A、放电时,Li+透过固体电解质向Cu极移动 |
| B、放电时,负极的电极反应式为CuO+H2O+2e---Cu+2OH- |
| C、通空气时,铜被腐蚀,表面产生Cu2O |
| D、整个反应过程中,铜相当于催化剂 |
下列属于吸热反应同时又属于氧化还原反应的是( )
| A、Ca(OH)2与NH4Cl的反应 |
| B、点燃的镁条在二氧化碳中继续燃烧 |
| C、灼热的碳与二氧化碳的反应 |
| D、酸碱中和反应 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移4 NA个电子 |
| B、常温下,4 g CH4含有NA个C-H共价键 |
| C、标准状态下,33.6 L氟化氢中含有1.5 N A个氟原子 |
| D、常温下,286 g Na2CO3?10H2O晶体中含有的CO32-小于NA个 |
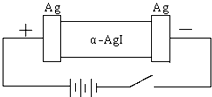 某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4
某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4