题目内容
1.利用化学原理对废气、废水进行脱硝、脱碳、脱硫处理.可实现绿色环保、废物利用,对构建生态文明有重要意义:Ⅰ.脱硝:
(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol-1
H2O(g)═H2O(l)△H=-44kJ•mol-1
H2的燃烧热为285.8KJ•mol-1
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
(2)用NH3催化还原法消除氮氧化物,发生反应:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0
相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,
反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)微生物燃料电池(MFC)是一种现代化氨氮去除技术.下图为MFC碳氮联合同时去除的氮转化系统原理示意图.

①已知A、B两极生成CO2和N2的物质的量之比为5:2,写出A极的电极反应式CH3COO--8e-+2H2O═2CO2+7H+.
②解释去除NH4+的原理NH4+在好氧微生物反应器中转化为NO3-,NO3-在MFC电池正极转化为N2.
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染.常温下,将a mol•L-1醋酸与bmol•L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7L/mol(用含a、b的代数式表示).
Ⅲ、脱硫:燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵
(5)室温时,向(NH4)2 SO4溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)=c(NH3•H2O)(填“>”“<”或“=”)
分析 (1)依据热化学方程式和盖斯定律计算所得热化学方程式;
(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,根据v(NO)=$\frac{△c}{△t}$计算;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.改变压强,活化分子百分数不变;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质;
②NH4+在好氧微生物反应器中转化为NO3-,硝酸根离子在原电池正极发生还原反应生成氮气;
(4)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算;
(5)根据电荷守恒:c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(OH-),由物料守恒可知c(NH4+)+c(NH3•H2O)=2c(SO42-),结合溶液呈中性,联立判断.
解答 解:Ⅰ. 已知:H2的热值为142.9KJ•g-1 ,燃烧热为285.8KJ/mol,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
③H2O(g)=H2O(l)△H=-44kJ•mol-1
根据盖斯定律,①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1;
(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)=$\frac{\frac{3mol}{2L}}{4min}$=0.375mol•L-1•min-1,
故答案为:0.375mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,当温度不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质,则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-═N2+6H2O,
故答案为:CH3COO--8e-+2H2O═2CO2+7H+;
②NH4+在好氧微生物反应器中转化为NO3-:NH4++2O2═NO3-+2H++H2O,硝酸根离子在原电池正极发生还原反应生成氮气:2NO3-+12H++10e-═N2+6H2O,
故答案为:NH4+在好氧微生物反应器中转化为NO3-,NO3-在MFC电池正极转化为N2;
(4)反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,据电荷守恒可知:c(H+)=c(OH-)=10-7mol/L,溶液呈中性,则醋酸电离平衡常数为K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}$×10-7,
故答案为:$\frac{2b}{a-2b}$×10-7L/mol;
(5)根据电荷守恒:c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(OH-),溶液呈中性,而c(H+)=c(OH-),故c(NH4+)+c(Na+)=2c(SO42-),由物料守恒可知c(NH4+)+c(NH3•H2O)=2c(SO42-),联立可得c(Na+)=c(NH3•H2O),
故答案为:=.
点评 本题考查较为综合,涉及物质的量随计算变化的曲线、化学平衡常数的计算、反应热与焓变的应用、化学反应速率的计算等知识,题目难度较大,明确化学平衡及其影响为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及综合应用能力.

| A. | 还原剂与氧化剂的物质的量之比为3:1 | |
| B. | H2O既不作氧化剂又不作还原剂 | |
| C. | 每生成1 mol SO2转移4 mol电子 | |
| D. | S2Cl2只作氧化剂 |
| A. | 少量SO2通入足量NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | 将氨通入稀硫酸中:NH3+H+═NH4+ | |
| C. | 在NaOH溶液中滴入NH4Cl溶液并加热:NH4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O | |
| D. | 向Ba(OH)2溶液中加入稀H2SO4恰好完全反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |

| A. | 和金属钠反应键①断裂 | |
| B. | 在铜催化下和O2反应键①③断裂 | |
| C. | 乙醇与金属钠反应比水与金属钠反应缓慢 | |
| D. | 钠与乙醇反应时,钠熔化成一个小球在乙醇表面不断的游动 |

| A. | 装置①是电解Na2SO4溶液联合生产硫酸和烧碱示意图,若气体甲,乙的体积比约为1:2,则离子交换膜c、d均为阴离子交换膜,产物丙为硫酸溶液 | |
| B. | 装置②是以肼(N2H4)为燃料的电池装置,a极的反应式:N2H4+4OH--4e-=N2↑+4H2O | |
| C. | 装置③是在待镀铁制品上镀铜的实验装置,电镀过程中电极Ⅱ上Cu2+放电而使溶液中Cu2+浓度逐渐变小 | |
| D. | 装置④是金属牺牲阳极的阴极保护法实验装置,加入K3[Fe(CN)6]溶液后,Fe电极附近会产生蓝色沉淀 |
| A. | 形成化合物种类最多的原子 | |
| B. | M层有5个电子的原子 | |
| C. | N层上电子数与K层电子数相等,次外层有8个电子的原子 | |
| D. | 原子核外最外层电子数等于电子层数的原子 |
| A. | 氰的分子式为(CN)2,分子中含有3个σ键和4个π键 | |
| B. | 甲醇(CH3OH)分子内的O-C-H键角小于甲醛(HCHO)分子内的O-C-H键角 | |
| C. | 第二周期基态原子未成对电子数与Ni相同且第一电离能最小的元素是氧 | |
| D. | 二氧化硅晶体中最小的环有3个硅原子、3个氧原子 |
| A. | 该变化说明原子核在化学反应中也能发生变化 | |
| B. | 该变化遵循质量守恒定律 | |
| C. | 1n是一种电中性粒子 | |
| D. | 对于30P:原子序数=质子数=中子数=核外电子数 |
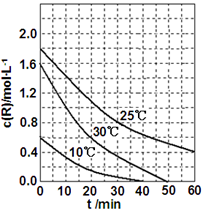 为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )
为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )| A. | 25℃时,在10~30min内,R 的分解平均速率为0.030 mol•L-1•min-1 | |
| B. | 对比30℃和10℃曲线,在50min时,R的分解百分率相等 | |
| C. | 对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速率随温度升高而增大 | |
| D. | 对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大 |