题目内容
9.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界中不存在的P的一种同位素--30P,开创了人造核素的先河:27Al+4He-→30P+1n.下列有关说法不正确的是( )| A. | 该变化说明原子核在化学反应中也能发生变化 | |
| B. | 该变化遵循质量守恒定律 | |
| C. | 1n是一种电中性粒子 | |
| D. | 对于30P:原子序数=质子数=中子数=核外电子数 |
分析 根据化学反应的最小微粒是原子,所有的反应都遵循质量守恒定律,质量数等于质子数加中子数,并结合同位素的概念等分析.
解答 解:A.原子核在一般的化学反应中不能发生变化,化学反应的最小微粒是原子,故A错误;
B.所有的反应都遵循质量守恒定律,故B正确;
C.01n中仅有1个中子,无质子和电子,是一种电中性粒子,故C正确;
D.1530P是原子,中子数为30-15=15,对该原子来说,则存在原子序数=质子数=中子数=核外电子数,故D正确;
故选A.
点评 本题考查化学变化的概念,明确质子数、中子数、核外电子数、质量数关系即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.aR3-和bMn+的核外电子数相等,则a值等于( )
| A. | b+n+3 | B. | b+n-3 | C. | b-n+3 | D. | b-n-3 |
17.乙基香草醛(结构为 )的同分异构体有多种.符合下列条件的同分异构体有( )种
)的同分异构体有多种.符合下列条件的同分异构体有( )种
①能与NaHCO3溶液反应 ②遇FeCl3溶液显紫色且能与浓溴水反应
③苯环上有两个烃基 ④苯环上的官能团处于对位.
 )的同分异构体有多种.符合下列条件的同分异构体有( )种
)的同分异构体有多种.符合下列条件的同分异构体有( )种①能与NaHCO3溶液反应 ②遇FeCl3溶液显紫色且能与浓溴水反应
③苯环上有两个烃基 ④苯环上的官能团处于对位.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
4.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 反应进行30s时,正反应速率等于逆反应速率 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 前60 s,以X浓度变化表示的平均反应速率为0.0005mol/(L•s) | |
| D. | 反应进行80s时,X物质的量浓度为0.04mol/L |
14.下列说法不正确的是( )
| A. | 氢键在形成蛋白质结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子光谱可用于测定物质中元素的种类 | |
| C. | a粒子散射实验及布朗运动的发现都对原子模型建立做出了贡献 | |
| D. | X-射线衍射实验可以用来鉴别晶体和非晶体 |
1. 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如表所示:
(1)步骤一所用仪器已有托盘天平(带砝码)、玻璃棒、烧杯、药匙,还缺少的仪器250mL容量瓶、胶头滴管.
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如表所示:
| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 见右图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
19.五氧化二氮(N2O5)是有机合成中常用的绿色硝化剂,可用NO2与O3反应制得.某化学兴趣小组设计如下实验装置制备N2O5(部分装置略去).

(1)铜和浓硝酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.加入浓硝酸后,装置Ⅰ中烧瓶上部可观察到的现象是有红棕色气体生成.
(2)仪器a的名称为球形干燥管,该仪器中盛装的试剂是D(填标号).
A.生石灰B.浓硫酸C.碱石灰D.五氧化二磷
(3)已知下列物质的有关数据.
装置Ⅱ中持续通入O3,为得到尽可能多的纯净的N2O5,温度控制在24℃〜32℃.收集到的N2O5固体中含有液态物质,可能原因是干燥不完全,导致有硝酸生成.
(4)装置Ⅲ的作用是安全瓶,防止倒吸.
(5)化学兴趣小组用制得的N2O5制备少量对硝基甲苯( ,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:
,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:
①制备对硝基甲苯的化学方程式为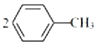 +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O.
+H2O.
②N2O5生成对硝基甲苯的转化率为21.05%.

(1)铜和浓硝酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.加入浓硝酸后,装置Ⅰ中烧瓶上部可观察到的现象是有红棕色气体生成.
(2)仪器a的名称为球形干燥管,该仪器中盛装的试剂是D(填标号).
A.生石灰B.浓硫酸C.碱石灰D.五氧化二磷
(3)已知下列物质的有关数据.
| 物质 | 熔点/℃ | 沸点/℃ |
| N2O5 | 41 | 32 (升华) |
| N2O4 | -11 | 24 |
(4)装置Ⅲ的作用是安全瓶,防止倒吸.
(5)化学兴趣小组用制得的N2O5制备少量对硝基甲苯(
 ,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:
,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:①制备对硝基甲苯的化学方程式为
 +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O.
+H2O.②N2O5生成对硝基甲苯的转化率为21.05%.


 .
.