题目内容
4.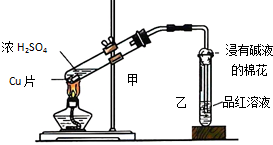 实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:
实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:(1)判断铜跟浓硫酸反应有SO2生成的依据是品红溶液褪色.写出甲装置中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)装置乙的试管口放有一团浸有饱和氢氧化钠溶液的棉花,其目的是吸收SO2,防止SO2污染空气,棉花中发生反应的离子方程式是SO2+2NaOH=Na2SO3+H2O.
(3)实验中除了(1)小题中观察到的实验现象外,还可以观察到其它的实验现象,请你任写一种:溶液显蓝色.
分析 (1)Cu与浓硫酸反应生成二氧化硫,二氧化硫能使品红褪色,在加热条件下Cu与浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)浸有碱液的棉花可吸收过量的二氧化硫,防止污染环境;
(3)Cu与浓硫酸反应生成硫酸铜溶液,溶液显蓝色.
解答 解:(1)Cu与浓硫酸反应生成二氧化硫,二氧化硫能使品红褪色,在加热条件下Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,化学反应为Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:品红溶液褪色;Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)盛放品红溶液的试管口放一团浸有碱液的棉花,作用是吸收SO2,防止污染空气,反应的化学方程式为2NaOH+SO2=Na2SO3+H2O;
故答案为:吸收SO2,防止SO2污染空气;2NaOH+SO2=Na2SO3+H2O;
(3)Cu与浓硫酸反应生成硫酸铜溶液,溶液显蓝色,
故答案为:溶液显蓝色.
点评 本题考查实验装置的综合应用,综合性较强,把握实验原理、铜与浓硫酸的反应为解答的关键,侧重化学实验和元素化合物性质的考查,题目难度不大.

练习册系列答案
相关题目
14.将22.6g的铜、锌合金溶于一定量的某浓度硝酸中,将放出的气体与3.92L(标准状况下)氧气混合后通入水中被水完全吸收,则合金中铜的质量为( )
| A. | 12.8g | B. | 9.6g | C. | 6.4g | D. | 3.2g |
12.下列对卤素性质的说法不符合递变规律的是( )
| A. | F2、Cl2、Br2、I2的氧化性逐渐减弱 | |
| B. | HF、HCl、HBr、HI的热稳定性逐渐减弱 | |
| C. | F-、Cl-、Br-、I-的还原性逐渐增强 | |
| D. | 卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大 |
16.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下11.2 L甲烷含有2NA个共价键 | |
| B. | 4.8 g Mg和氯气反应得到电子数为0.4 NA个 | |
| C. | 0.1 mol•L-1的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个 |
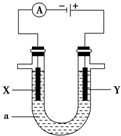 电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:
电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:
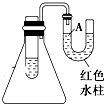 如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题: