题目内容
13.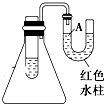 如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:(1)有关反应的离子方程式是Mg+2H+═Mg2++H2↑,试管中看到的现象是片上有大量气泡生成,镁片不断溶解.
(2)U形导管中液面A下降(填“上升”或“下降”),原因是镁片与稀盐酸反应时放出热量,使锥形瓶内温度升高,气体压强增大,说明此反应是放热(填“吸热”或“放热”)反应.
(3)由实验推知,MgCl2溶液和H2的总能量低于(填“高于”“低于”或“等于”)镁片和盐酸的总能量.
分析 (1)镁片与盐酸反应现象为镁片上有大量气泡生成,镁片不断溶解,二者反应生成氯化镁和氢气;
(2)镁片与盐酸的反应为放热反应,反应放出的热量使气体膨胀,据此回答;
(3)镁片与盐酸的反应为放热反应,反应物的总能量高于产物的总能量,据此回答.
解答 解:(1)镁片与盐酸反应的离子方程式为Mg+2H+═Mg2++H2↑,反应现象为镁片上有大量气泡生成,镁片不断溶解,
故答案为:Mg+2H+═Mg2++H2↑;片上有大量气泡生成,镁片不断溶解;
(2)镁片与盐酸的反应为放热反应,反应放出的热量使气体膨胀,使U形管液面A下降,
故答案为:下降;镁片与稀盐酸反应时放出热量,使锥形瓶内温度升高,气体压强增大;放热;
(3)镁片与盐酸的反应为放热反应,反应物的总能量高于产物的总能量,即MgCl2溶液和H2的总能量低于镁片和盐酸的总能量,故答案为:低于.
点评 本题考查吸热反应和放热反应,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
3.研究NO2、SO2、CO等大气污染气体的处理对环境保护有重要意义,某化学实验爱好小组拟用铜和浓硫酸来制备二氧化硫,以探究SO2的性质,设计如图1方案:
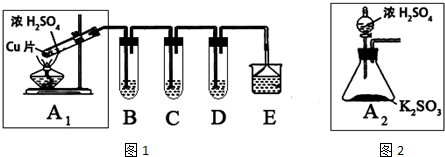
(1)请写出A1中发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)B、C、D分别用于检验SO2的还原性、氧化性和漂白性.其中C、D分别为硫化氢和品红的水溶液,则B中所盛试剂为碘水或溴水或酸性高锰酸钾溶液.
(3)为了实现绿色实验的目标,某同学重新设计了如图2A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是::①不用加热,安全性能高.②易于控制反应进行,反应更充分.(任写一个)(任写一点即可).
(4)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水.
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:

(1)请写出A1中发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)B、C、D分别用于检验SO2的还原性、氧化性和漂白性.其中C、D分别为硫化氢和品红的水溶液,则B中所盛试剂为碘水或溴水或酸性高锰酸钾溶液.
(3)为了实现绿色实验的目标,某同学重新设计了如图2A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是::①不用加热,安全性能高.②易于控制反应进行,反应更充分.(任写一个)(任写一点即可).
(4)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水.
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡),, 则“吸收液”中存在 SO32-. |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 | 若出现白色沉淀(或品红溶液褪色,或有气泡), 则“吸收液”中存在 HSO3-. |
1.把生锈的铁钉放入足量的盐酸中,可能发生的反应是( )
| A. | 只发生复分解反应 | B. | 只发生置换反应 | ||
| C. | 发生置换反应和化合反应 | D. | 发生复分解反应和置换反应 |
8.下列离子方程式不正确的是( )
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H+十SO42-→BaSO4↓+2H2O | |
| B. | CuSO4溶液与NaOH溶液反应:Cu2++2OH-→Cu(OH)2↓ | |
| C. | NaOH溶液中通入少量CO2:2OH-+CO2→CO32-+H2O | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-→H2O |
4. 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )| A. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ•mol-1 | |
| B. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ•mol-1 | |
| C. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ•mol-1 | |
| D. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ•mol-1 |
8.下列说法正确的是( )
| A. | 干燥的氯气有漂白性,还能用作杀菌消毒剂 | |
| B. | 含金属元素的离子不一定都是阳离子 | |
| C. | 工业上可通过电解饱和食盐水制得金属钠 | |
| D. | 氢氧化铝具有两性,既可溶于盐酸也可溶于氨水 |
9.1g苯(C6H6,液态)完全燃烧时生成二氧化碳和液态水,放出41.8kJ的热量,苯燃烧的热化学方程式正确的是( )
| A. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+41.8kJ | |
| B. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+3260.4kJ | |
| C. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+41.8kJ | |
| D. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+3260.4kJ |
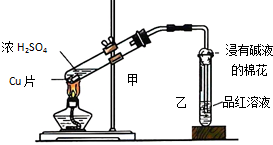 实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:
实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题: