题目内容
浓度为0.50mol/L的某金属阳离子Mn+的溶液10.00mL,与0.80mol/L的NaOH溶液12.50mL完全反应,生成沉淀,则n等于( )
| A、1 | B、2 | C、3 | D、4 |
考点:离子方程式的有关计算
专题:计算题
分析:根据n=cV计算Mn+、NaOH氢氧化钠的物质的量,氢氧化钠溶液中n(OH-)=n(NaOH),发生反应Mn++nOH-=M(OH)n↓,以此计算n的值.
解答:
解:n(Mn+)=0.01L×0.5mol/L=0.005mol,
氢氧化钠溶液中n(OH-)=n(NaOH)=0.0125L×0.8mol/L=0.01mol,
发生反应Mn++nOH-=M(OH)n↓,
则0.005mol:0.01mol=1:n,解得n=2,
故选B.
氢氧化钠溶液中n(OH-)=n(NaOH)=0.0125L×0.8mol/L=0.01mol,
发生反应Mn++nOH-=M(OH)n↓,
则0.005mol:0.01mol=1:n,解得n=2,
故选B.
点评:本题考查离子方程式的计算,为高频考点,把握物质的量的计算及发生的离子反应为解答的关键,注意利用电荷守恒计算更简便,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现由C6H12,CH3CHO,CH3COOH组成的混合物,已知O质量分数为a%,则碳的质量分数为( )
A、
| ||
| B、1-a% | ||
C、
| ||
D、
|
下列说法正确的是( )
| A、向饱和硼酸溶液中滴加Na2CO3溶液,有CO2气体生成 |
| B、KClO3积SO3溶于水后能导电,故KClO3和SO3为电解质 |
| C、AgCl沉淀易转化为AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)<Ksp(AgCl) |
| D、沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、2.4g金属镁变为镁离子时失去的电子数为0.2NA |
| B、1mol?L-1KCl溶液中含有Cl-的个数为NA |
| C、常温常压下,22.4LCl2与足量的金属钠充分反应,转移电子数为2NA |
| D、标准状况下,22.4L的水中含有NA个H2O分子 |
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,若有64gCu被氧化,则被还原的HNO3的质量是( )
| A、168g | B、42g |
| C、126g | D、60g |
1molPH3与1molH2S具有不同的是( )
| A、分子数目 | B、原子数目 |
| C、质量 | D、摩尔质量 |
含有0.30g甲醛的水溶液与过量银氨溶液充分反应,生成的银有( )
| A、0.02g |
| B、0.04g |
| C、2.16g |
| D、4.32g |
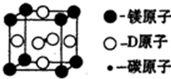 A、B、C、D是前四周期原予序数依次增大的四种元素,其中A和B原子的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.
A、B、C、D是前四周期原予序数依次增大的四种元素,其中A和B原子的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.