题目内容
2.氨、硝酸、硝酸铵、硝酸铜是重要的化工产品,工业合成氨与制备硝酸一般可连续生产,流程如图1,请回答下列问题:
(1)吸收塔中通入空气的作用是提供O2将NO、NO2氧化为HNO3;下列可以代替硝酸镁加入到蒸馏塔中的是A.
A.浓硫酸 B.氯化钙 C.生石灰 D.硝酸亚铁
(2)制硝酸尾气中的氮氧化物常用尿素[CO(NH2)2]作为吸收剂,其主要的反应为:NO、NO2混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2和N2,反应的化学方程式为NO+NO2+H2O=2HNO2、2HNO2+CO(NH2)2=CO2↑+2N2↑+3H2O.
(3)在氧化炉里,催化剂存在时氨气和氧气反应:4NH3+5O2?4NO+6H2O,4NH3+3O2?2N2+6H2O 在不同温度时生成产物如图2所示.在氧化炉里,反应温度通常控制在800℃~900℃的理由是在此温度范围里,主产物NO的产率较高.

(4)如图3所示装置可用于电解NO制备 NH4NO3,电解总反应方程式为8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,需补充氨气的理由是与电解产生的HNO3反应生成NH4NO3.
(5)工业上通常用铜与浓硝酸反应制得光谱纯硝酸铜晶体(化学式为Cu(NO3)2•3H2O,摩尔质量为242g/mol).已知:25℃、1.01×105Pa时,在密闭容器发生反应:2NO2?N2O4,达到平衡时,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L.现用一定量的Cu与足量的浓高纯度硝酸反应,制得5.00L已达到平衡的N2O4和NO2的混合气体(25℃、1.01×105Pa),理论上生成光谱纯硝酸铜晶体的质量为36.3g.
分析 工业制硝酸的流程图分析如下:1.在合成塔中,N2与H2化合生成NH3;2.将NH3和空气通入氧化炉里反应生成NO、NO2 3.将混合气体通入吸收塔中,空气中的O2将NO氧化为NO2,并与H2O、NO2反应生成HNO3 4.最后将生成的HNO3通入蒸馏塔中,加入硝酸镁进行浓缩,从而制得浓硝酸.
解答 解:(1)吸收塔主要吸收二氧化氮生成硝酸.另外从氧化炉里过来的气体中有NO,通入空气,可以将NO氧化为NO2,然后再与NO2、H2O反应生成HNO3;加入硝酸镁的作用是吸收水,而且不与硝酸反应,从而达到浓缩的目的.可以用浓硫酸来代替,既可以吸收水分,不易挥发,也不与硝酸反应.
故答案为:将NO、NO2等氧化为硝酸;A;
(2)由反应物和产物及质量守恒定律可知发生的反应为NO+NO2+H2O=2HNO2、CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O,
故答案为:NO+NO2+H2O=2HNO2;CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O;
(3)由所给图表,发现在800~900℃时,主产物NO的产率很高,而副产物N2的产率很低,
故答案为:800~900℃时副产物N2的产率较低,NO的产率很高;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此要使电解产物全部转化为NH4NO3,需补充NH3.
故答案为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3;将电解过程中生成的硝酸转化为硝酸铵;
(5)根据达到平衡时,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L,故5L混合气体中的NO2的物质的量n=CV=0.04mol/L×5L=0.2mol,
N2O4的物质的量n=CV=0.01mol/L×5L=0.05mol.
设反应物铜的物质的量为xmol,根据铜与浓硝酸反应时得失电子数守恒,即铜失去的电子的物质的量等于硝酸得到的电子的物质的量,可得:
2x=0.2mol×1+0.05mol×2
解得x=0.15mol
而Cu~Cu(NO3)2•3H2O,故生成的Cu(NO3)2•3H2O的物质的量为0.15mol,故质量m=nM=0.15mol×242g/mol=36.3g,
故答案为:36.3.
点评 本题考查了工业合成氨与制备硝酸、化学方程式的书写、电解原理的应用、守恒方法在化学计算中的应用的知识,题目综合性较强,难度中等,侧重于考查学生的分析能力和计算能力、以及对基础知识的综合应用能力.

| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D的原子结构示意图为
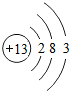 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.(3)A、B、C三种元素的原子半径由大到小的顺序为K>Na>Mg(填元素符号),其最高价氧化物对应水化物的碱性由强到弱顺序为KOH>NaOH>Mg(OH)2.(填化学式)
(4)F元素的氢化物的电子式为
 ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.(5)用电子式表示A与H形成化合物的过程为
 ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色. | A. | 石油裂解主要目的是得到短链的不饱和烃 | |
| B. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| C. | 煤的气化与液化都是化学变化 | |
| D. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| C. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高 价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低 价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
②B2C2与EC2反应:2K2O2+2CO2=2K2CO3+O2.
(3)A元素原子核外电子排布图是1s22s22p63s23p4;比元素B原子序数大11的元素的原子的电子排布式是1s22s22p63s23p63d104s2或者[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是氮(填元素名称).