题目内容
下列各图所示的实验原理、方法、装置、操作或叙述,不正确的是( )
A、 称量25.0g氯化钠固体 |
B、 收集NO2气体(尾气处理装置略) |
C、 检验出此装置漏气 |
D、 吸收NH3不会造成倒吸 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.称量固体,符合左物右码的原则;
B.二氧化氮的密度比空气的大,利用向上排空气收集;
C.没有加热或产生液柱,不能检查是否漏气;
D.有球形结构,具有缓冲作用,具有防止倒吸的作用.
B.二氧化氮的密度比空气的大,利用向上排空气收集;
C.没有加热或产生液柱,不能检查是否漏气;
D.有球形结构,具有缓冲作用,具有防止倒吸的作用.
解答:
解:A.称量固体,符合左物右码的原则,图中装置合理,故A正确;
B.二氧化氮的密度比空气的大,利用向上排空气收集,图中导管长进短出,装置合理,故B正确;
C.没有加热或产生液柱,不能检查是否漏气,若装置密封性不好,则分液漏斗下端导管与烧瓶中不出现液面差,故C错误;
D.有球形结构,具有缓冲作用,具有防止倒吸的作用,图中装置合理,故D正确;
故选C.
B.二氧化氮的密度比空气的大,利用向上排空气收集,图中导管长进短出,装置合理,故B正确;
C.没有加热或产生液柱,不能检查是否漏气,若装置密封性不好,则分液漏斗下端导管与烧瓶中不出现液面差,故C错误;
D.有球形结构,具有缓冲作用,具有防止倒吸的作用,图中装置合理,故D正确;
故选C.
点评:本题考查化学实验方案的评价,涉及称量、气体的收集及防止倒吸、装置气密性检查等,侧重实验操作和实验装置的考查,综合性较强,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列有关实验原理或操作不正确的是( )
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、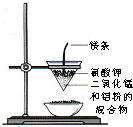 用如图装置制取少量金属锰 |
D、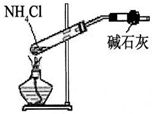 实验室用如图所示装置制取少量氨气 |
下列反应的离子方程式书写正确的是( )
| A、大理石和盐酸的反应:CO32-+2H+=CO2↑+H2O | ||||
| B、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ | ||||
| C、氯气与氢氧化钠溶液反应:Cl2+OH-=Cl-+HClO | ||||
D、电解饱和食盐水:2Cl-+2H2O
|
常温下,将v1mL c1mol?L-1的氨水逐滴滴加到v2mL c2mol?L-1的盐酸中,下列结论中正确的是( )
| A、若v1=v2c1=c2,则混合液中c(NH4+)=c(C1-) |
| B、若混合液的pH=7,则混合液中c(NH4+)>c(C1-) |
| C、若v1=v2且pH<7,则一定有c1<c2 |
| D、若混合液的pH=7,则c1v1>c2v2 |
 FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )
FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )| A、△H>O |
| B、反应处于D点时,一定有v正<v逆 |
| C、溶液中c(Fe3+):A点>B点 |
| D、T1、T2时相应的平衡常数分别为K1、K2,则K1<K2 |
下列说法正确的是( )
| A、电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B、氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C、向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D、粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
下列描述违背化学原理的是( )
| A、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- |
| B、将SO2通入酸性高锰钾溶液中,溶液褪色,不能说明SO2具有漂白性 |
| C、高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强 |
| D、亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应 |

 则△H2
则△H2