题目内容
15.某化学小组设计了如图1所示的数字化实验装置,研究常温下,向1L0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图2所示,则下列说法中正确的是( )
| A. | pH=4.0时,图中n(HA-)约为0.0091mol | |
| B. | 该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂 | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
分析 A.pH=3时A2-、HA-的物质的量分数相等,所以二者的浓度相等,则Ka2=$\frac{c({A}^{2-}).c({H}^{+})}{c(H{A}^{-})}$=c(H+)=0.001mol/L,由同一溶液中$\frac{c({A}^{2-})}{c(H{A}^{-})}$=$\frac{n({A}^{2-})}{n(H{A}^{-})}$,pH=4时该酸的第二步电离常数不变,且原溶液中n(HA-)+n(A2-)=0.1mol,据此计算n(HA-);
B.根据图知,滴定终点时溶液呈酸性;
C.pH=3时,溶液中不存在H2A,说明该酸第一步完全电离,第二步部分电离,则NaHA只电离不水解,Na2A能水解,且c(A2-)=c(HA-);
等物质的量浓度的NaHA与Na2A溶液等体积混合,因为电离、水解程度不同导致c(A2-)、c(HA-)不一定相等;
D.该二元酸第一步完全电离,第二步部分电离,所以NaHA溶液中不存在H2A.
解答 解:A.pH=3时A2-、HA-的物质的量分数相等,所以二者的浓度相等,则Ka2=$\frac{c({A}^{2-}).c({H}^{+})}{c(H{A}^{-})}$=c(H+)=0.001mol/L,由同一溶液中$\frac{c({A}^{2-})}{c(H{A}^{-})}$=$\frac{n({A}^{2-})}{n(H{A}^{-})}$,pH=4时该酸的第二步电离常数不变,且原溶液中n(HA-)+n(A2-)=0.1mol,Ka2=$\frac{c({A}^{2-}).c({H}^{+})}{c(H{A}^{-})}$=$\frac{n({A}^{2-})}{n(H{A}^{-})}$c(H+)=$\frac{n({A}^{2-})}{n(H{A}^{-})}$×0.0001mol/L=0.001mol/L,n(HA-)约为0.0091mol,故A正确;
B.根据图知,滴定终点时溶液呈酸性,应该选取甲基橙作指示剂,故B错误;
C.pH=3时,溶液中不存在H2A,说明该酸第一步完全电离,第二步部分电离,则NaHA只电离不水解,Na2A能水解,且c(A2-)=c(HA-);等物质的量浓度的NaHA与Na2A溶液等体积混合,因为电离、水解程度不同导致c(A2-)、c(HA-)不一定相等,则混合溶液的pH不一定等于3,故C错误;
D.该二元酸第一步完全电离,第二步部分电离,所以NaHA只能电离不能水解,则溶液中不存在H2A,根据物料守恒得c(A2-)+c(HA-)=0.1mol/L,故D错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析推断及计算能力,正确判断该二元酸“第一步完全电离、第二步部分电离”是解本题关键,注意电离平衡常数只与温度有关,与溶液中溶质及其浓度无关,易错选项是D,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 水溶液中:K+、Ca2+、C1-、NO${\;}_{3}^{-}$ | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO${\;}_{4}^{2-}$、I- |
| A. | 水煤气 | B. | 焦炉煤气 | C. | 石油液化气 | D. | 高炉煤气 |
| A. | 生铁比纯铁更易锈蚀 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 纯银器在空气中表面渐渐变暗是因为发生了原电池反应 | |
| D. | 充电电池的充放电次数有限是由它的工作原理所决定的 |
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O与18O的质量数相同 | |
| D. | 标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1 NA 个氧原子 |
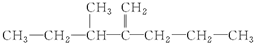 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯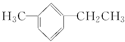 ,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.
,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.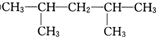
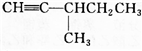 .
.
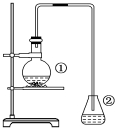 为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应. ②中离子方程式为Br-+Ag+═AgBr↓.
②中离子方程式为Br-+Ag+═AgBr↓.