题目内容
5.16O和18O是氧元素的两种核素,NA 表示阿伏加德罗常数,下列说法正确的是( )| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O与18O的质量数相同 | |
| D. | 标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1 NA 个氧原子 |
分析 A.16O2与18O2为一种物质氧气;
B.16O与18O的质子数均为8;
C.16O与18O的质量数分别为16、18;
D.结合n=$\frac{V}{Vm}$、N=nNA及分子构成计算.
解答 解:A.16O2与18O2为一种物质氧气,为同种物质,而同分异构体为分子式相同、结构不同的化合物,故A错误;
B.16O与18O的质子数均为8,则核外电子排布方式相同,故B错误;
C.16O与18O的质量数分别为16、18,则质量数不同,故C错误;
D.标准状况下,1.12 L 16O2和1.12 L 18O2的物质的量均为n=$\frac{V}{Vm}$=$\frac{1.12L}{22.4L/mol}$=0.05mol,为双原子构成的分子,均含0.1 NA 个氧原子,故D正确;
故选D.
点评 本题考查物质的量的计算,为高频考点,把握质量与物质的量的关系、分子构成为解答的关键,侧重分析与计算能力的考查,注意判断原子的构成及分子的构成,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.某化学小组设计了如图1所示的数字化实验装置,研究常温下,向1L0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图2所示,则下列说法中正确的是( )


| A. | pH=4.0时,图中n(HA-)约为0.0091mol | |
| B. | 该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂 | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
13.下列有关的离子方程式书写正确的是( )
| A. | 氢氧化钡溶液和稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| B. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 钠放于水中:2Na+2H2O=2Na++2OH-+H2↑ |
10.(1)元素周期表分为7个横行,即7个周期,周期表中有18个纵行,共16个族.
(2)写出下列物质的电子式:①CO2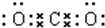 ;②NaOH
;②NaOH .
.
(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
①在这些元素中最活泼的非金属元素是F.
②元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH.
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
④在③~⑦元素中,原子半径最大的是Na.
(2)写出下列物质的电子式:①CO2
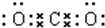 ;②NaOH
;②NaOH .
.(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
②元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH.
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
④在③~⑦元素中,原子半径最大的是Na.
14.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | CO2通入NaClO溶液中能生成HClO |
| B | 根据溶液的pH与溶液酸碱性的关系 | pH=6.8的溶液一定显酸性 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 同主族元素从上至下非金属性减弱 | HF、HCl、HBr、HI的酸性依次减弱 |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法正确的是( )
| A. | 油脂、氨基酸、蛋白质都是人体重要的营养物质,它们都会水解 | |
| B. | 分子组成为CH4或C2H6O的有机物都不存在同分异构现象 | |
| C. | 欲将蛋白质从水中析出而又不改变它的性质,可加入CuSO4溶液 | |
| D. | 利用二氧化碳制造可降解塑料代替聚乙烯塑料,可减少“白色污染” |
 ;反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
;反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.