题目内容
6.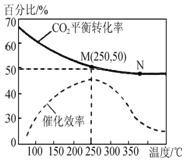 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )| A. | 平衡常数:KM>KN | |
| B. | 生成乙烯的速率一定有:v(M)<v(N) | |
| C. | 若投料比n(H2):n(CO2)=3:1,O 达到平衡时,M点乙烯的体积分数约为7.7% | |
| D. | 甲、乙、丙三个相同的恒容密闭容器中均充入0.3molH2和0.1molCO2,加入相同量的催化剂,反应温度T(甲)>T(乙)>T(丙),反应相同时间时,生成乙烯的产量一定为:甲>乙>丙 |
分析 A.升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动;
B.温度升高化学反应速率加快,催化剂的催化效率降低;
C.设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%
所以有6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
以此计算;
D.如温度高于250℃,催化剂催化效率降低,升高温度,反应速率反而减小.
解答 解:A.升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故A正确;
B.化学反应速率随温度的升高而加快,催化剂的催化效率降低,不能确定M、N的反应速率大小,故B错误;
C.设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%
所以有6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%=7.7%,故C正确;
D.如温度高于250℃,催化剂催化效率降低,升高温度,反应速率反而减小,则反应相同时间时,生成乙烯的产量可能为甲<乙<丙,故D错误.
故选BD.
点评 本题考查化学平衡的计算、判断等,为高考常见题型,侧重考查学生的分析能力和计算能力,注意图象分析化学反应速率的影响因素、平衡计算、平衡移动等,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | MgCl2晶体 | B. | NaCl溶液 | C. | 液态氯化氢 | D. | 熔融的KOH |
 伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )| A. | 该原电池正极的电极方程式为:O2+4e-+4H+═2H2O | |
| B. | 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O | |
| C. | 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g | |
| D. | 该伏打电堆工作时,在银板附近会有Cl2放出 |
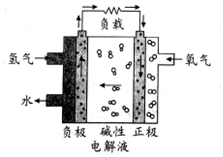
| A. | 通入氢气的电极发生氧化反应 | |
| B. | 正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 碱性电解液中阳离子向通入氢气的方向移动 | |
| D. | 放电过程中碱性电解液的pH不变 |
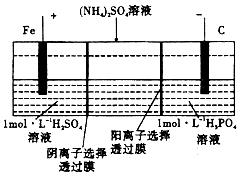
| A. | 阳极室溶液由无色变成浅绿色 | |
| B. | 当电路中通过lmol电子的电量时,阴极有0.5mol的气体生成 | |
| C. | 电解时中间室(NH4)2SO4溶液浓度下降 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| C. | 1.5mol的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 1L0.01 mol•L-1CKA1(SO4)2溶液中含有的阳离子数为0.02NA |
| 选项 | 现象或事实 | 解释 |
| A | 液氨可用作制冷剂 | NH3的化学性质稳定,不易发生反应 |
| B | 小苏打片用于治疗胃酸过多 | Na2CO3能与盐酸反应,降低胃液的酸度 |
| C | SO2可用作葡萄酒的食品添加剂 | SO2具有漂白性,能杀菌、消毒 |
| D | Al(OH)3用作塑料等材料的阻燃剂 | 受热易分解生成Al2O3和H2O,同时吸收热量 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 纤维素是多糖,但不能作人类的营养物质 | |
| B. | 生理盐水就是物质的量浓度为0.9 mol/L的氯化钠水溶液 | |
| C. | 葡萄酒中可添加适量的二氧化硫起抗氧化、防腐和杀菌等作用 | |
| D. | “卤水点豆腐”就是胶体的聚沉,豆腐、豆腐脑就是凝聚的豆类蛋白质 |