题目内容
7.实验室测得4molSO2参加下述反应:已知2SO2(g)+O2(g)?2SO3(g);△H=-197kJ•mol-1,当放出314.3kJ热量时,SO2的转化率最接近于( )| A. | 40% | B. | 50% | C. | 80% | D. | 90% |
分析 根据反应放出的热量计算转化的二氧化硫物质的量,转化率=$\frac{物质的量变化量}{起始物质的量}$×100%,以此解答该题.
解答 解:设反应的二氧化硫为x,则
2SO2(g)+O2(g)?2SO3(g);△H=-197kJ•mol-1,
2 mol 197kJ
x 314.3kJ
$\frac{2}{x}$=$\frac{197}{314.3}$,解得x=3.19mol,
所以SO2的转化率为$\frac{3.19}{4}$×100%≈80%,
故选C.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,涉及热化学反应方程式的计算,明确热化学方程式的意义及物质的量与热量的关系即可解答,题目难度不大.

练习册系列答案
相关题目
6.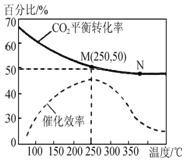 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )| A. | 平衡常数:KM>KN | |
| B. | 生成乙烯的速率一定有:v(M)<v(N) | |
| C. | 若投料比n(H2):n(CO2)=3:1,O 达到平衡时,M点乙烯的体积分数约为7.7% | |
| D. | 甲、乙、丙三个相同的恒容密闭容器中均充入0.3molH2和0.1molCO2,加入相同量的催化剂,反应温度T(甲)>T(乙)>T(丙),反应相同时间时,生成乙烯的产量一定为:甲>乙>丙 |
7.下列有关说法正确的是( )


| A. | CO2 晶胞如图1所示,一个CO2 分子周围有12个CO2 分子紧邻 | |
| B. | 由E原子和F原子构成的气态团簇分子模型如图2所示,其分子式为EF或FE | |
| C. | H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动 | |
| D. | 金属Cu原子堆积模型如图4所示,该金属晶体为六方最密堆积,Cu原子的配位数为12 |
15.对于实验I〜IV的描述正确的是( )


| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡. | |
| B. | 实验II:充分振荡后静置,下层溶液为橙红色,上层无色 | |
| C. | 实验III:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置IV:逐滴加入NaOH溶液时,可以看到白色沉淀,转而变成灰绿色,最后是红褐色 |
2.下列除杂试剂或操作方法不正确的是( )
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl | BaCl2 | 加入过量的K2CO3溶液,过滤,再加适量的盐酸并加热 |
| ② | FeSO4溶液 | CuSO4 | 加入过量Fe粉,过滤 |
| ③ | CO2 | HCl | 通过盛饱和Na2CO3溶液洗气瓶,再通过盛H2SO4洗气瓶 |
| ④ | 自来水 | 植物油 | 萃取分液 |
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②④ |
12.常见无机物A、B、C、D存在如图转化关系(部分产物已略去),下列说法错误的是( )

| A. | 若B、D是空气的主要成分,则A可能用做制冷剂 | |
| B. | 若A、B、C的水溶液均显碱性,焰色反应均为黄色,则C可能用做胃酸中和剂 | |
| C. | 若D为生产生活中用量最大、用途最广泛的金属单质,则B可能为Fe( NO3)2 | |
| D. | 若B具有两性,则D可能为NaOH溶液或盐酸 |
19.标准状况下,11.2L氧气的质量是( )
| A. | 8 g | B. | 16 g | C. | 32 g | D. | 4 g |
16.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol/L的硫酸溶液中含有的H+离子数为2NA | |
| B. | 常温下,11.2L甲烷气体含有的甲烷分子数为0.5NA | |
| C. | 22.4L NO2和CO2混合气体中含有的氧原子数为2NA | |
| D. | 标准状况下,18gH2O所含的氧原子数目为NA |
17.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同族,则下列推断中正确的是( )
| A. | A、B、E一定处于三个不同的短周期 | |
| B. | A、D不可能在同一主族 | |
| C. | C的最高价氧化物对应的水化物可能显碱性 | |
| D. | C和D的单质不可能化合成1:1型离子化合物 |