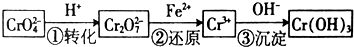题目内容
9.某工厂用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下.回答下列问题:
(1)硫酸铵在农业生产中的用途是(一种即可)用作肥料,写出利用该流程制备(NH4)2SO4的总化学方程:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4.
(2)a和b分别是B(填序号).
A.足量CO2、适量NH3 B.足量NH3、适量CO2
C.适量CO2、足量NH3 D.适量NH3、足量CO2
(3)上述流程中,可以循环使用的物质有CO2、NH3(写化学式).
(4)从滤液中获得(NH4)2SO4晶体,必要的操作步骤是蒸发浓缩、冷却结晶、过滤.
(5)上述流程中,有关NH3作用的说法正确的是ABD.
A.提供制备所需的氮元素 B.增大CO32-的浓度促进反应发生
C.作反应的催化剂 D.生产1mol (NH4)2SO4,至少消耗2mol NH3.
分析 流程中,向硫酸钙浊液中通入足量的氨气,使溶液成碱性,再通人适量的二氧化碳利于反应的进行,硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀,加热制成饱和溶液,再降温冷却,结晶析出,过滤,则可以使硫酸铵从溶液中结晶析出.
(1)根据硫酸铵中含有氮元素在农业上可做化学肥料;该流程中硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀;
(2)碱性溶液会吸收更多的二氧化碳,利于反应的进行;
(3)根据可以循环使用的f物质参加反应,并且要生成回答,二氧化碳、氨气参与了化学反应,也是生成物;
(4)硫酸铵由溶液中结晶析出的方法是冷却热饱和溶液的方法;
(5)A.氨气能提供制备所需的氮元素;
B.氨气溶于水形成的溶液呈碱性,增大CO32-的浓度促进反应发生;
C.氨气是反应物;
D.设生产132g(NH4)2SO4,至少消耗NH3的质量为x,根据反应CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4来计算.
解答 解:流程中,向硫酸钙浊液中通入足量的氨气,使溶液成碱性,再通人适量的二氧化碳利于反应的进行,硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀,加热制成饱和溶液,再降温冷却,结晶析出,过滤,则可以使硫酸铵从溶液中结晶析出.
(1)硫酸铵中含有氮元素,在如图流程中,硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀物质发生的主要化学反应为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4.故答案为:用作肥料;CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4;
(2)向硫酸钙浊液中通入足量的氨气,使溶液成碱性,再通人适量的二氧化碳利于反应的进行;故答案为:B;
(3)二氧化碳、氨气参与了化学反应,也是生成物,所以二氧化碳可以循环使用,故答案为:CO2、NH3;
(4)使硫酸铵从溶液中结晶析出的方法是先加热制成饱和溶液,再降温冷却,结晶析出,过滤,故答案为:蒸发浓缩、冷却结晶、过滤;
(5)A.氨气能提供制备所需的氮元素,故正确;
B.氨气溶于水形成的溶液呈碱性,增大CO32-的浓度促进反应发生,故正确;
C.氨气不是作反应的催化剂,故错误;
D.设生产132g(NH4)2SO4,至少消耗NH3的质量为x,
CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4
34 132
x 132g
$\frac{34}{x}$=$\frac{132}{132g}$,解得:x=34g,故生产1mol (NH4)2SO4,至少消耗2mol NH3,故正确.
故选:ABD.
点评 本题属于新信息题,通过一个陌生的反应考查了有关硫酸铵和二氧化碳的知识,因此同学们要充分利用所给的信息,不要被无用的信息迷惑,结合自己已学过的知识,进行有依据性的判断,难度较大.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(2)温度为T时,该反应的化学平衡常数=0.025
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%
要提高平衡时PCl3的体积分数,可采取的措施有CD
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| A. | 加热后在空气中冷却称量固体 | B. | 晶体中含有加热易挥发的杂质 | ||
| C. | 实验所取晶体已有部分脱水 | D. | 晶体加热时脱水不完全 |
①晶体中含有受热不分解的杂质;
②晶体尚带蓝色,即停止加热;
③加热过程中,晶体有部分爆溅飞出坩埚.
其中能使实验结果n值偏低的是( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
| A. | 恒重操作是指加热、冷却、称量这一过程重复两次 | |
| B. | 加热时不断用玻璃棒搅拌 | |
| C. | 加热时晶体不小心溅出坩埚,再加一些胆矾 | |
| D. | 为了节约时间,加热时直接用大火加热直至最后 |
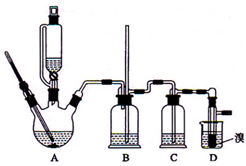 实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题: