题目内容
20.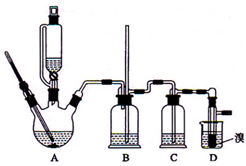 实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:(1)写出装置A中制备乙烯的化学方程式C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)实验开始要尽可能快地把反应温度提高到170℃,其最主要目的是D.
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(3)在装置C中应加入C (填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体.
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(5)若产物中有少量未反应的Br2,最好用b洗涤除去.
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)装置B的作用有两个,分别是检查实验进行时试管D是否发生堵塞和防止倒吸.
(7)若产物中有少量副产物乙醚,可用蒸馏法的方法除去.
(8)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是产品熔点低,过度冷却会凝固而堵塞导管口.
(9)判断该制备反应已经结束的最简单方法是D中溴水完全褪色.
分析 (1)乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度发生脱水反应生成乙烯;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下加热到140度发生副反应生成乙醚;
(3)浓硫酸具有脱水性,强氧化性,能够与乙醇脱水生成的碳发生氧化还原反应生成二氧化硫、二氧化碳气体,二者为酸性氧化物能够与碱液反应;
(4)1,2-二溴乙烷密度大于水,不溶于水;
(5)要出去1,2-二溴乙烷中的溴,应选择能够与溴反应或者溶解溴而不溶解1,2-二溴乙烷或者与1,2-二溴乙烷反应的物质;
(6)1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据玻璃导管中内外液面高低变化,可以判断是否发生堵塞;
(7)依据乙醚与1,2-二溴乙互溶,二者熔沸点不同选择分离方法;
(8)乙烯与溴反应时放热,冷却可避免溴的大量挥发,但不能过度冷却(如用冰水),否则使气路堵塞;
(9)溴水为橙黄色,如果完全反应生成的1,2-二溴乙烷无色.
解答 解:(1)乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度发生脱水反应生成乙烯,方程式:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下加热到140度发生副反应生成乙醚,所以要制备乙烯应尽可能快地把反应温度提高到170℃,减少副产物乙醚的生成;
故选:D;
(3)浓硫酸具有脱水性,强氧化性,能够与乙醇脱水生成的碳发生氧化还原反应生成二氧化硫、二氧化碳气体,二者为酸性氧化物能够与碱液反应,为除去乙烯中的二氧化硫、二氧化碳气,应选择碱性溶液;
A.二氧化碳水溶性较细,吸收不充分,故A不 选;
B.二氧化碳、二氧化硫与浓硫酸不反应,不能用浓硫酸吸收,故B不选;
C.二氧化硫、二氧化碳气为酸性氧化物,能够与氢氧化钠溶液反应而被吸收,故C选;
D.碳酸氢钠不能吸收二氧化碳,故D不选;
故选:C;
(4)1,2-二溴乙烷密度大于水,不溶于水,所以:将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层;
故答案为:下;
(5)A.溴更易溶于1,2-二溴乙烷,用水无法除去溴,故a不选;
B.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,但1,2-二溴乙烷在氢氧化钠水溶液、加热条件下容易发生水解反应,低温下,可用氢氧化钠出去溴杂质,故B选;
C.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c不选;
D.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故c不选;
故选:b;
(6)1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据玻璃导管中内外液面高低变化,可以判断是否发生堵塞;
故答案为:防止倒吸;
(7)乙醚与1,2-二溴乙互溶,二者熔沸点不同选择,应用蒸馏的方法分离二者;
故答案为:蒸馏法;
(8)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管;
故答案为:产品熔点低,过度冷却会凝固而堵塞导管;
(9)溴水为橙黄色,如果完全反应生成的1,2-二溴乙烷无色,所以可以通过观察D中溴水是否完全褪色判断制备反应已经结束;
故答案为:D中溴水完全褪色.
点评 本题考查有机物合成实验,主要考查了乙醇制备1,2-二溴乙烷,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 第一电离能:N>O | B. | 第一电子亲和能:F<Cl | ||
| C. | 电负性:O<Cl | D. | 共价键的键角:NH3<H2S |
资料卡片:
| 一些物质的溶解性 | ||||
| OH- | Cl- | SO42- | CO32- | |
| H+ | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| 杂质 | 加入的试剂 |
| CaCl2 | ⅠNa2CO3 |
| MgCl2 | ⅡNaOH |
| 硫酸盐 | ⅢBaCl2 |
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-.其中盐酸除去CO32-的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O.
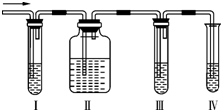
 在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.
C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混有的HCl气体.
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体.请通过简单实验判断该晶体是碳酸氢钠晶体晶体而不是碳酸氢铵晶体,简述操作方法、实验现象及结论:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3.
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.88g,则NaHCO3的产率为70%.
| A. | 从合成塔出来的混合气体,其中NH3只占15%,所以合成氨工厂的效率都很低 | |
| B. | 由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高 | |
| C. | 合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动 | |
| D. | 合成氨工厂采用的压强是2×107~5×107Pa,因为在该压强下铁触媒的活性最大 |
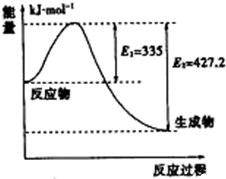 由化学能转变的热能或电能是人类使用的最主要的能源.
由化学能转变的热能或电能是人类使用的最主要的能源.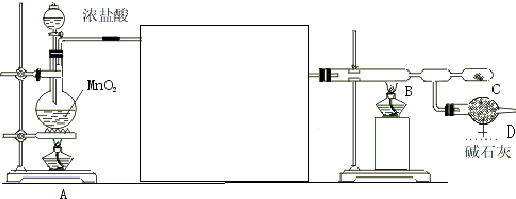
 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题: