题目内容
13.下列说法正确的是( )| A. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | CH3COOH是弱电解质,NH3•H2O是弱电解质,故CH3COONH4也是弱电解质 |
分析 A.一水合氨为弱电解质,其电离程度与溶液的浓度大小有关,浓度越大,电离程度越小;
B.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),以此分析;
C.向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液反应得到等浓度的碳酸钠和碳酸氢钠混合溶液,碳酸根离子水解程度大于碳酸氢根离子水解程度;
D.水溶液中部分电离的电解质为弱电解质.
解答 解:A.相同温度下,1mol•L-1氨水与0.5mol•L-1氨水中,氨水浓度越大,一水合氨的电离程度越小,所以两溶液中c(OH-)之比小于2:1,故A错误;
B.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故B正确;
C.向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液反应得到等浓度的碳酸钠和碳酸氢钠混合溶液,碳酸根离子水解程度大于碳酸氢根离子水解程度,:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.CH3COOH是弱电解质,NH3•H2O是弱电解质,CH3COONH4是盐在水溶液中完全电离,是强电解质,故D错误;
故选B.
点评 本题考查酸碱溶液的混合、电解质溶液中电荷守恒、物料守恒、涉及电离、水解、酸碱混合的定性判断等,注重高考常考考点的考查,侧重反应原理的训练,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A | B | C | D |
 | 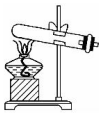 |  |  |
| 混合反应物 | 生成乙酸乙酯 | 收集乙酸乙酯 | 分离乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 酒精和水 | B. | 植物油和水 | ||
| C. | 四氯化碳和稀硫酸 | D. | 氢氧化钠溶液和四氯化碳 |
| A. | 正丁烷的结构简式:C4H10 | |
| B. | S2-的结构示意图: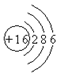 | |
| C. | NH3的电子式: | |
| D. | 碳酸钠电离方程式:Na2CO3=Na++CO32- |
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 溶液从烧杯转移到容量瓶后没有洗涤烧杯 | |
| C. | 未冷却即将溶液转移到容量瓶 | |
| D. | 加水未达到容量瓶刻度线 |
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题. 实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)
实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)