题目内容
2.配制一定体积、一定物质的量浓度的溶液,下列操作会使配得的溶液浓度偏小的是( )| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 溶液从烧杯转移到容量瓶后没有洗涤烧杯 | |
| C. | 未冷却即将溶液转移到容量瓶 | |
| D. | 加水未达到容量瓶刻度线 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$,凡是使n偏小或者使V偏大的操作,所配溶液浓度都偏小,反之溶液浓度偏大,据此解答.
解答 解:A.容量瓶中原有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故A不选;
B.溶液从烧杯转移到容量瓶后没有洗涤烧杯,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏小,故B选;
C.未冷却即将溶液转移到容量瓶,定容后,待溶液冷却液面下降,溶液体积偏小,溶液浓度偏大,故C不选;
D.加水未达到容量瓶刻度线,导致溶液体积偏小,溶液浓度偏大,故D不选;
故选:B.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理,准确判断操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列说法正确的是( )
| A. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | CH3COOH是弱电解质,NH3•H2O是弱电解质,故CH3COONH4也是弱电解质 |
10.CO(g)+H2O(g)?Η2(g)+CO2(g)△H<0,在其他条件不变的情况下( )
| A. | 加入催化剂,改变了反应的途径,加快了反应速率,反应的△H也之改变 | |
| B. | 改变压强,反应速率发生改变,但平衡不发生移动,反应放出的热量不变 | |
| C. | 温度降低,正、逆反应速率都减小,反应放出的热量不变 | |
| D. | 恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
7. 于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )
于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )
 于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )
于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )| A. | 当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2 | |
| B. | 左端装置中化学能转化为电能,右端装置中电能转化为化学能 | |
| C. | c极上发生的电极反应是:O2+2H2O+4e-=4OH- | |
| D. | d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A池 |

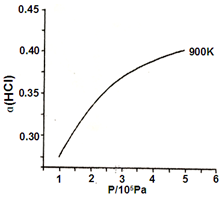 氯及其化合物在生活和生产中应用广泛.
氯及其化合物在生活和生产中应用广泛.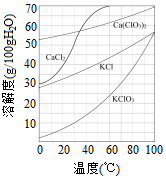 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为:
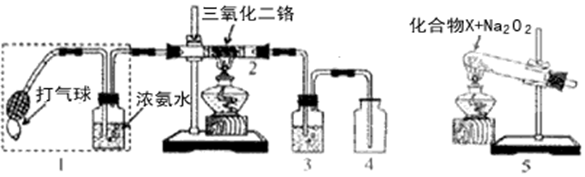
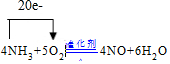 .
.