题目内容
5.下列化学用语表示正确的是( )| A. | 正丁烷的结构简式:C4H10 | |
| B. | S2-的结构示意图: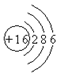 | |
| C. | NH3的电子式: | |
| D. | 碳酸钠电离方程式:Na2CO3=Na++CO32- |
分析 A.C4H10为正丁烷的分子式,不是结构简式;
B.硫离子的核外电子总数为18,最外层达到8电子稳定结构;
C.氨气为共价化合物,分子中含有3个N-H键;
D.电离方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.正丁烷的碳原子不能合并,其正确的结构简式为:CH3CH2CH2CH3,故A错误;
B.S2-的核电荷数为16,核外电子总数为18,其正确的离子结构示意图为: ,故B错误;
,故B错误;
C.NH3为共价化合物,N原子最外层达到8电子稳定结构,其电子式为: ,故C正确;
,故C正确;
D.碳酸钠为强电解质,在溶液中完全电离,其电离方程式为:Na2CO3=2Na++CO32-,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及结构简式、电子式、电离方程式、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
相关题目
12.某有机物分子式为C5H9O2Cl,该物质能与NaHCO3溶液反应生成CO2.则符合条件的有机物最多有(不考虑立体异构)( )
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 16种 |
16.下列各式中不正确的是( )
| A. | HF+H2O?H3O++F- | |
| B. | NaHCO3=Na++HCO3-,HCO3-?H++CO32- | |
| C. | Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| D. | S2-+2H2O?H2S+2OH- |
13.下列说法正确的是( )
| A. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | CH3COOH是弱电解质,NH3•H2O是弱电解质,故CH3COONH4也是弱电解质 |
10.CO(g)+H2O(g)?Η2(g)+CO2(g)△H<0,在其他条件不变的情况下( )
| A. | 加入催化剂,改变了反应的途径,加快了反应速率,反应的△H也之改变 | |
| B. | 改变压强,反应速率发生改变,但平衡不发生移动,反应放出的热量不变 | |
| C. | 温度降低,正、逆反应速率都减小,反应放出的热量不变 | |
| D. | 恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
15.(1)在探究金属钠与水反应的实验过程中,某课外小组同学记录了如下实验现象和实验结论,请填写下表中的空格(从①~⑧中选择,填序号):①有碱生成 ②溶液变红 ③钠四处游动 ④钠浮在水面上 ⑤有气体产生 ⑥钠的密度比水小 ⑦钠熔成光亮的小球 ⑧反应放热,钠熔点低
(2)少量金属钠投入到CuSO4溶液中,正确的反应方程式是C
①2Na+CuSO4═Na2SO4+Cu↓
②Cu+2H2O═Cu(OH)2+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
A.①③B.①②C.③④D.①
| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
①2Na+CuSO4═Na2SO4+Cu↓
②Cu+2H2O═Cu(OH)2+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
A.①③B.①②C.③④D.①
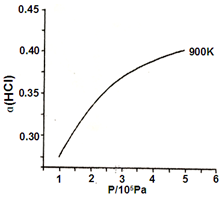 氯及其化合物在生活和生产中应用广泛.
氯及其化合物在生活和生产中应用广泛.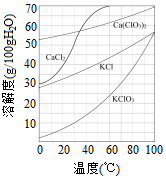 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为: