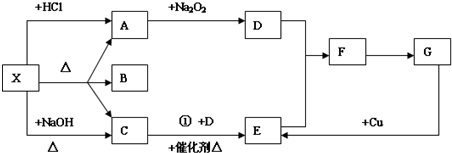
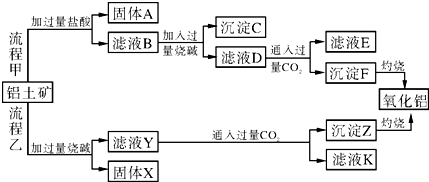
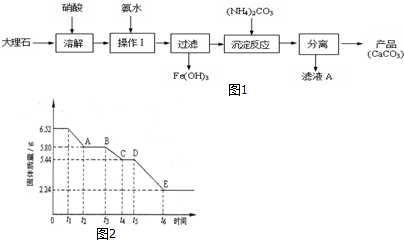
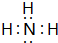题目内容
19.设NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 44g14C1802所含有的中子数为28NA | |
| B. | 32gCH4中所含共价键数为8NA | |
| C. | 7.8gNa2O2固体中所含离子数为0.4NA | |
| D. | 17gOH-所含有的电子数为9NA |
分析 A.14C1802的摩尔质量为50g/mol,14C1802分子中含有中子数为:8+20=28,据此计算44g该二氧化碳分子中含有的中子数;
B.甲烷分子中含有4个碳氢共价键,32g甲烷的物质的量为2mol,含有8mol共价键;
C.过氧化钠的化学式中含有2个钠离子、1个过氧根离子,根据n=$\frac{m}{M}$计算出过氧化钠的物质的量,然后计算出含有离子数;
D.氢氧根离子中含有10个电子,17g氢氧根离子的物质的量为1mol,含有10mol电子.
解答 解:A.14C1802分子中含有中子数为:8+10×2=28,44g 14C1802的物质的量为:$\frac{44g}{50g/mol}$=$\frac{22}{25}$mol,含有的中子的物质的量为:$\frac{22}{25}$mol×28<28mol,则含有的中子数小于28NA,故A错误;
B.32gCH4的物质的量为:$\frac{32g}{16g/mol}$=2mol,2mol甲烷分子中含有共价键的物质的量为:2mol×4=8mol,则所含共价键数为8NA,故B正确;
C.7.8g Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1molNa2O2中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,所含离子数为0.3NA,故C错误;
D.17gOH-的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氢氧根离子含有10mol电子,所含有的电子数为10NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,C为易错点,注意过氧化钠中的阴离子为过氧根离子,试题培养了学生的分析能力及化学计算能力.

| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 每消耗0.1molNH4HCO3放出2.24L CO2 |
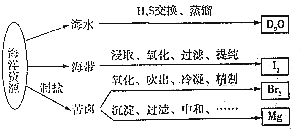
| A. | 从海水中提取D2O是化学变化 | |
| B. | 从海带中提取I2时可用乙醇进行萃取 | |
| C. | 实验室用带玻璃塞的棕色试剂瓶贮存液溴 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/l的NaAlO2溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀 |

| A. | a极附近溶液呈红色 | |
| B. | a极电极反应方程式是:2H++2e-=H2↑ | |
| C. | b极附近溶液呈蓝色 | |
| D. | 溶液的pH变小 |
| A. | 灼热的炭与CO2反应 | B. | H-Cl→H+Cl | ||
| C. | H2SO4+2NaOH=Na2SO4+2H2O | D. | C(s)+H2O(g)=CO(g)+H2(g) |