题目内容
2.下列各组微粒的空间构型相同的是( )①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和C2H2
⑥SiO44-和ClO4-.
| A. | 全部 | B. | 除①④⑥以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
分析 根据价层电子对互斥理论确定微粒空间构型,价层电子对个数=σ键+孤电子对个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,据此判断.
解答 解:①NH3中价层电子对个数=3+$\frac{1}{2}$×(5-3)=4且含有一个孤电子对,所以为三角锥形,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2)=4且含有两个孤电子对,所以为V形结构,二者空间构型不同,故①错误;
②NH4+中价层电子对个数是4且不含孤电子对,为正四面体形结构;H3O+中O原子价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,二者空间构型不同,故②错误;
③NH3为三角锥形结构、H3O+中O原子价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,所以二者空间构型相同,故③正确;
④O3、SO2中价层电子对个数都是3且都含有一对孤电子对,所以分子空间构型都是V形,故④正确;
⑤CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$(4-2×2)=2,二氧化碳是直线型结构,乙炔的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,为直线形结构;CO2和C2H2分子都是直线型分子,故⑤正确;
⑥SiO44-中价层电子对个数=4+$\frac{1}{4}$(4+4-4×2)=4,不含孤电子对,所以是正四面体形,ClO4-中价层电子对个数=4+$\frac{1}{4}$(7+1-4×2)=4,不含孤电子对,所以是正四面体形,两者空间构型相同,故⑥正确;
故选C.
点评 本题考查了微粒空间构型的判断,根据价层电子对理论解答,注意孤电子对个数=$\frac{1}{2}$×(a-xb)中各个字母的含义,H3O+中O原子价层电子对个数,为易错点,⑥孤电子对的确定为该题的难点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 反应前O2的体积为560 mL | B. | 化合物XY3的摩尔质量为86 g/mol | ||
| C. | XY3的质量为0.99g | D. | 反应后气体总质量约为1.79 g |
| A. | 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 向 NaClO 溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO3- | |
| C. | 向偏铝酸钠溶液中加入碳酸氢钠:AlO2-+3HCO3-═Al(OH)3↓+3CO2↑ | |
| D. | 向NH4HCO3溶液中加入过量NaOH溶液:NH4++HCO3-+2OH-═NH3•H2O+H2O+CO32- |
| A. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 室温下,测得氯化铵溶液pH<7:NH4++H2O=NH3•H2O+H+ | |
| C. | 石灰水中加入过量碳酸氢钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用小苏打片治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
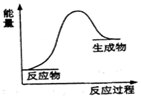
| A. | Ba(OH)2•8H2O与NH4Cl反应 | |
| B. | 铝与稀盐酸 | |
| C. | 灼热的炭与水蒸气生成一氧化碳和氢气的反应 | |
| D. | 煤与O2的燃烧反应 |
| A. | 1 mol甲基(CH3-)所含的电子数分别为10NA | |
| B. | 标准状况下,22.4 L四氯化碳中含有C-Cl键的数目为4NA | |
| C. | 常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 46g 由NO2和N2O4组成的混合气体中,含有的原子总数为3NA |