题目内容
12.一定量的液态化合物XY3,在一定量O2中恰好完全反应:XY3(l)+4O2(g)═XO2(g)+3YO2(g),冷却后在标准状况下,测得生成物的体积为560mL,密度为3.20g•L-1.下列说法中错误的是( )| A. | 反应前O2的体积为560 mL | B. | 化合物XY3的摩尔质量为86 g/mol | ||
| C. | XY3的质量为0.99g | D. | 反应后气体总质量约为1.79 g |
分析 A.根据方程式计算氧气的体积;
B.根据M=$\frac{m}{n}$计算化合物XY3的摩尔质量;
C.据化学反应遵循质量守恒定律,则m(XY3)+m(O2)=m(XO2)+m(YO2)=0.560L×3.20g•L-1=1.792g,m(XY3)=1.792g-m(O2)=1.792g-$\frac{0.560L}{22.4L/mol}$×32g/mol=0.992g;
D.据m=ρv进行计算.
解答 解:A.由方程式XY3(l)+4O2(g)═XO2(g)+3YO2可以看出,V(O2)=V(XO2)+V(YO2)=560mL,故A正确;
B.化学反应遵循质量守恒定律,则m(XY3)+m(O2)=m(XO2)+m(YO2)=0.560L×3.20g•L-1=1.792g,
m(XY3)=1.792g-m(O2)=1.792g-$\frac{0.560L}{22.4L/mol}$×32g/mol=0.992g,
由方程式可知,n(XY3)=$\frac{1}{3}$×n(O2)=$\frac{1}{3}×$$\frac{0.560L}{22.4L/mol}$=$\frac{1}{120}$mol,
M(XY3)=$\frac{0.992g}{\frac{1}{120}mol}$=119g/mol,故B错误;
C.由B中计算过程的m(XY3)=0.992g≈0.99g,故C正确;
D.m=ρV=0.560L×3.20g•L-1=1.792g,故D正确;
故选B.
点评 本题考查物质的量的相关计算,题目难度不大,注意从质量守恒的角度,结合化学方程式计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.短周期元素X、Y、Z、W的原子序数依次递增,其原子的最外层电子数之和为15.X与Y、Z、W位于相邻周期,Z最外层电子数与周期数相等,W的一种氧化物是主要的大气污染物.下列叙述正确的是( )
| A. | 原子半径的大小顺序:r (W)>r (Z)>r (Y)>r (X) | |
| B. | 最高价氧化物对应的水化物的碱性:Y>Z | |
| C. | X、W的简单气态氢化物都易溶于水 | |
| D. | Z的最高价氧化物对应的水化物一定能溶于X的最高价氧化物对应的水化物 |
13.荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )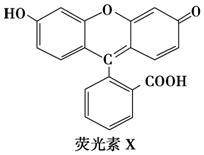

| A. | 1 mol X与足量的NaOH溶液在常温常压下反应,最多消耗3 mol NaOH | |
| B. | X能与糠醛( 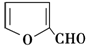 )发生缩聚反应 )发生缩聚反应 | |
| C. | 1 mol X与足量的浓溴水反应,最多消耗4 mol Br2 | |
| D. | 1 mol X最多能与9 mol氢气反应 |
7.用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是( )
| A. | 相同状况下两电极上产生的气体体积之比为2:1 | |
| B. | 两电极上产生的气体质量之比为8:1 | |
| C. | 相同状况下两电极上产生的气体体积之比为4:1 | |
| D. | 若两电极上产生的气体质量比为16:3,则D2O与H2O的物质的量之比为2:1 |
1.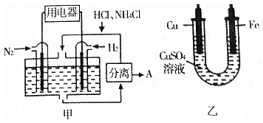 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
下列说法中正确的是( )
 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.下列说法中正确的是( )
| A. | 通入H2-极与图乙中的铜电极相连 | |
| B. | 电池工作一段时间后,溶液pH减少1 | |
| C. | 当消耗0.025molN2时,则铁电极增重1.6g | |
| D. | 通入N2-端的电极反应式为:N2+8H++6e-═2NH4+ |
2.下列各组微粒的空间构型相同的是( )
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和C2H2
⑥SiO44-和ClO4-.
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和C2H2
⑥SiO44-和ClO4-.
| A. | 全部 | B. | 除①④⑥以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |

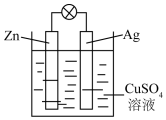 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.