题目内容
13.下列离子方程式正确的是( )| A. | 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 向 NaClO 溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO3- | |
| C. | 向偏铝酸钠溶液中加入碳酸氢钠:AlO2-+3HCO3-═Al(OH)3↓+3CO2↑ | |
| D. | 向NH4HCO3溶液中加入过量NaOH溶液:NH4++HCO3-+2OH-═NH3•H2O+H2O+CO32- |
分析 A.稀硝酸具有强氧化性,能够将亚铁离子氧化;
B.次氯酸根离子能够氧化二氧化硫;
C.碳酸氢根离子的酸性大于氢氧化铝,二者反应生成氢氧化铝沉淀和碳酸钠,不会生成二氧化碳;
D.氢氧化钠过量,铵根离子和碳酸氢根离子都参与反应.
解答 解:A.向氢氧化亚铁中加入足量的稀硝酸,二者发生氧化还原反应,正确的离子反应为:NO3-+3Fe(OH)2+10H+=3Fe3++NO↑+8H2O,故A错误;
B.向 NaClO 溶液中通入过量SO2气体,二氧化硫被氧化成硫酸,正确的离子方程式为:ClO-+H2O+SO2═2H++Cl-+SO42-,故B错误;
C.向偏铝酸钠溶液中加入碳酸氢钠,反应生成氢氧化铝沉淀和碳酸钠,正确的离子方程式为:AlO2-+H2O+HCO3-═Al(OH)3↓+CO32-,故C错误;
D.向NH4HCO3溶液中加入过量NaOH溶液,反应的离子方程式为:NH4++HCO3-+2OH-═NH3•H2O+H2O+CO32-,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )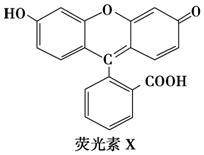

| A. | 1 mol X与足量的NaOH溶液在常温常压下反应,最多消耗3 mol NaOH | |
| B. | X能与糠醛( 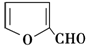 )发生缩聚反应 )发生缩聚反应 | |
| C. | 1 mol X与足量的浓溴水反应,最多消耗4 mol Br2 | |
| D. | 1 mol X最多能与9 mol氢气反应 |
1.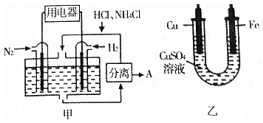 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
下列说法中正确的是( )
 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.下列说法中正确的是( )
| A. | 通入H2-极与图乙中的铜电极相连 | |
| B. | 电池工作一段时间后,溶液pH减少1 | |
| C. | 当消耗0.025molN2时,则铁电极增重1.6g | |
| D. | 通入N2-端的电极反应式为:N2+8H++6e-═2NH4+ |
8.不同实验需要使用不同的酸,以下情况中酸的使用合理的是( )
| A. | 焰色反应前用硫酸洗涤铂丝 | |
| B. | 用硫酸干燥Cl2、HCl、CO2、H2 | |
| C. | 用盐酸酸化KMnO4溶液滴入FeSO4溶液,证明Fe2+具有还原性 | |
| D. | 先加硝酸酸化,再加BaCl2溶液检验未知溶液中的SO42-离子 |
18.下列分子中所有碳原子肯定不在同一平面上的是( )
| A. |  | B. | CH3CH=CHCH3 | C. | CH2=CHCH2CH3 | D. |  |
5.下列实验装置或操作设计正确、且能达到目的是( )
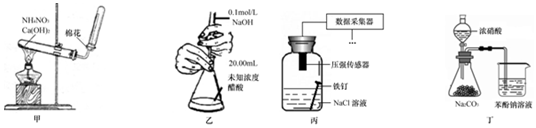

| A. | 用甲装置制取氨气 | |
| B. | 用乙装置测定醋酸浓度 | |
| C. | 用丙装置采集到的压强数据判断铁钉发生电化学腐蚀类型 | |
| D. | 用丁装置验证酸性:硝酸>碳酸>苯酚 |
2.下列各组微粒的空间构型相同的是( )
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和C2H2
⑥SiO44-和ClO4-.
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和C2H2
⑥SiO44-和ClO4-.
| A. | 全部 | B. | 除①④⑥以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
7.下列有关说法正确的是( )
| A. | 明矾既可用作净水剂,也可用作消毒剂 | |
| B. | 小苏打、氢氧化铝都可用于治疗胃酸过多 | |
| C. | 煤的干馏、石油的分馏都属于化学变化 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体 |
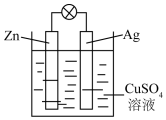 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.