题目内容
配制400mL 0.5mol?L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将 (填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为 假定最终称得小烧杯的质量为 (填“32.6g”或“31.61g”),
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm处;
③将NaOH溶液沿玻璃棒注入500mL容量瓶中;
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序 _.
(4)某学生实际配制NaOH溶液的浓度为0.48mol?L-1,原因可能是 .
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解NaOH的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
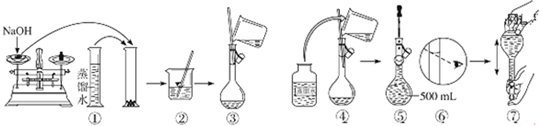
(5)在如图配制0.5mol?L-1 NaOH溶液过程示意图中有错误的(填序号) .
(1)计算:需要NaOH固体的质量为
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm处;
③将NaOH溶液沿玻璃棒注入500mL容量瓶中;
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序
(4)某学生实际配制NaOH溶液的浓度为0.48mol?L-1,原因可能是
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解NaOH的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
(5)在如图配制0.5mol?L-1 NaOH溶液过程示意图中有错误的(填序号)

考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据n=c×V、m=n×M计算需要氯化钠的质量;
(2)托盘天平的精确度为0.1g,分度盘的指针偏右,说明右边重,将左边的横梁螺丝往外调调节平衡;根据使用托盘天平时,加砝码的正确操作完成;
(3)根据配制一定物质的量浓度的溶液的方法对各选项进行排序;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)依据配置一定物质的量浓度溶液的正确操作步骤和仪器的正确使用方法解答.
(2)托盘天平的精确度为0.1g,分度盘的指针偏右,说明右边重,将左边的横梁螺丝往外调调节平衡;根据使用托盘天平时,加砝码的正确操作完成;
(3)根据配制一定物质的量浓度的溶液的方法对各选项进行排序;
(4)根据c=
| n |
| V |
(5)依据配置一定物质的量浓度溶液的正确操作步骤和仪器的正确使用方法解答.
解答:
解:(1)配制400mL 0.5mol?L-1的NaOH溶液,应选择500ml的容量瓶,需要的氢氧化钠的物质的量n=0.5mol?L-1×0.5L=0.25mol,其质量m=0.25mol×40g/mol=10.0mol;
故答案为:10.0g;
(2)分度盘的指针偏右,说明右边重,左盘高于右盘.应将左边的横梁螺丝往外调以调节平衡.托盘天平的精确度为0.1g,故应为32.6g;
故答案为:高于;将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡;32.6g;
(3)配制0.5L 0.5mol?L-1的NaCl溶液的步骤有:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,则正确的操作顺序是:①③④②⑤;
故答案为:①③④②⑤;
(4)A.使用滤纸称量氢氧化钠固体,氢氧化钠潮解,称取的氢氧化钠的物质的量偏小,溶液浓度偏低,故A正确;
B.容量瓶中原来存有少量蒸馏水,对n与V都不会产生影响,溶液的浓度不变,故B错误;
C.溶解NaOH的烧杯未经多次洗涤,溶质的物质的量减少,溶液的浓度偏低,故C正确;
D.胶头滴管加水后定容时仰视刻度,导致溶液的体积偏大,溶液的浓度偏低,故D正确;
故选:ACD;
(5)①量筒为精密仪器,不能用来溶解物质,故①错误;
②用玻璃杯搅拌加速固体的溶解,故②正确;
③玻璃棒引流操作时,玻璃棒下端应靠在容量瓶刻度线下方,故③错误;
④洗涤烧瓶和玻璃棒,将洗液转移到容量瓶,操作正确,故④正确;
⑤定容时,开始直接向容量瓶加蒸馏水,到离刻度线1-2CM改用胶头滴管加蒸馏水至刻度线,操作正确,故⑤正确;
⑥定容时,眼睛平视刻度线,故⑥错误;
⑦加盖摇匀,使溶液混合均匀,操作正确,故⑦正确;
故选:①③⑥;
故答案为:①③⑥.
故答案为:10.0g;
(2)分度盘的指针偏右,说明右边重,左盘高于右盘.应将左边的横梁螺丝往外调以调节平衡.托盘天平的精确度为0.1g,故应为32.6g;
故答案为:高于;将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡;32.6g;
(3)配制0.5L 0.5mol?L-1的NaCl溶液的步骤有:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,则正确的操作顺序是:①③④②⑤;
故答案为:①③④②⑤;
(4)A.使用滤纸称量氢氧化钠固体,氢氧化钠潮解,称取的氢氧化钠的物质的量偏小,溶液浓度偏低,故A正确;
B.容量瓶中原来存有少量蒸馏水,对n与V都不会产生影响,溶液的浓度不变,故B错误;
C.溶解NaOH的烧杯未经多次洗涤,溶质的物质的量减少,溶液的浓度偏低,故C正确;
D.胶头滴管加水后定容时仰视刻度,导致溶液的体积偏大,溶液的浓度偏低,故D正确;
故选:ACD;
(5)①量筒为精密仪器,不能用来溶解物质,故①错误;
②用玻璃杯搅拌加速固体的溶解,故②正确;
③玻璃棒引流操作时,玻璃棒下端应靠在容量瓶刻度线下方,故③错误;
④洗涤烧瓶和玻璃棒,将洗液转移到容量瓶,操作正确,故④正确;
⑤定容时,开始直接向容量瓶加蒸馏水,到离刻度线1-2CM改用胶头滴管加蒸馏水至刻度线,操作正确,故⑤正确;
⑥定容时,眼睛平视刻度线,故⑥错误;
⑦加盖摇匀,使溶液混合均匀,操作正确,故⑦正确;
故选:①③⑥;
故答案为:①③⑥.
点评:本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
25℃时,下列溶液中水的电离程度最大的是( )
| A、0.01 mol/L盐酸 |
| B、0.01 mol/L Na2CO3溶液 |
| C、pH=4 的NaHSO3溶液 |
| D、pH=11氨水 |
绚丽的焰火将上海世博会开幕式推向了高潮.焰火与高中化学中“焰色反应”知识有关.下列有关“焰色反应”说法中正确的是( )
| A、焰色反应为化学变化 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、焰色反应均应透过蓝色钴玻璃观察 |
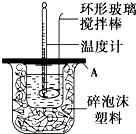 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题: