题目内容
1.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是( )| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 原氨水中有1%的含氮微粒为NH4+ | |
| C. | 反应后的溶液呈酸性 | |
| D. | 混合溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=5×10-4mol/L |
分析 A.常温下,pH=1的盐酸溶液中c(HCl)=0.1mol/L,pH=11的氨水溶液中氨水浓度大于0.001mol/L,等体积混合后二者恰好完全反应,说明氨水与盐酸的物质的量相等;
B.氨水溶液中存在c(OH-)≈c(NH4+)=0.001mol/L,铵根离子浓度与氨水浓度接近1:100;
C.强酸弱碱盐溶液呈酸性;
D.二者混合后溶液体积增大一倍,导致浓度降为原来的一半,且溶液中存在物料守恒.
解答 解:A.常温下,pH=1的盐酸溶液中c(HCl)=0.1mol/L,pH=11的氨水溶液中氨水浓度大于0.001mol/L,等体积混合后二者恰好完全反应,说明氨水与盐酸的物质的量相等,二者体积相等,则物质的量浓度相等,为0.1mol/L,故A错误;
B.氨水溶液中存在c(OH-)≈c(NH4+)=0.001mol/L,铵根离子浓度与氨水浓度接近1:100,所以原氨水中有1%的含氮微粒为NH4+,故B正确;
C.强酸弱碱盐溶液呈酸性,氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,故C正确;
D.二者混合后溶液体积增大一倍,导致浓度降为原来的一半,且溶液中存在物料守恒,二者混合后结合物料守恒得c(NH4+)+c(NH3•H2O)+c(NH3)=0.05mol/L,故D错误;
故选AD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确弱电解质电离特点、盐的性质、酸碱反应等知识点是解本题关键,注意D中二者混合溶液体积改变导致浓度改变,为易错点.

练习册系列答案
相关题目
11.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
12.氢气、甲烷完全燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
将氢气、甲烷按一定比例混合,所得气体的密度是相同条件下N2的$\frac{1}{2}$,则9.8g该混合物完全燃烧能放出的热量最多为( )
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
将氢气、甲烷按一定比例混合,所得气体的密度是相同条件下N2的$\frac{1}{2}$,则9.8g该混合物完全燃烧能放出的热量最多为( )
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
9.组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有N(写元素符号),它的原子最外层共有5种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置第二周期IVA族.
(2)糖类是人体获得能量的来源之一.已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804kJ的热量,该反应的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)△H=-2804kJ•mol-1.
(3)CO2是一种温室气体,它的电子式为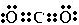 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是d(填序号).
a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系同类分子中(同主族元素原子与相同其他原子等合理均可),键长越小,键能越大.
(1)这六种元素中除H、C、O、P、S外,应该还有N(写元素符号),它的原子最外层共有5种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置第二周期IVA族.
(2)糖类是人体获得能量的来源之一.已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804kJ的热量,该反应的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)△H=-2804kJ•mol-1.
(3)CO2是一种温室气体,它的电子式为
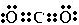 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.(4)元素周期表中元素的性质存在递变规律,下列关系正确的是d(填序号).
a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
16.下列说法正确的是( )
| A. | 难失去电子的原子,易形成阴离子 | |
| B. | 只有化合物分子中才存在共价键 | |
| C. | 共价分子中所有原子都具有8电子稳定结构 | |
| D. | 含氧酸的组成中可以含有金属元素 |
19.过氧化钾与水的反应类似于过氧化钠与水的反应,其化学方程式为:2K2O2+2H2O=4KOH+O2↑当0.5mol K218O2与足量H2O完全反应后,下表对生成物O2的叙述中错误的是( )
| K218O2的质量 | O2的叙述 | |
| A | 57g | O2的质量为9g |
| B | 57g | 生成标准情况下O2的体积为5.6L |
| C | 114g | O2的摩尔质量是32g•mol-1 |
| D | 57g | 生成0.25molO2 |
| A. | A | B. | B | C. | C | D. | D |
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种. .
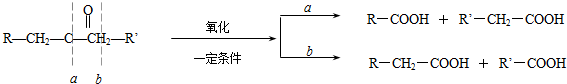
.
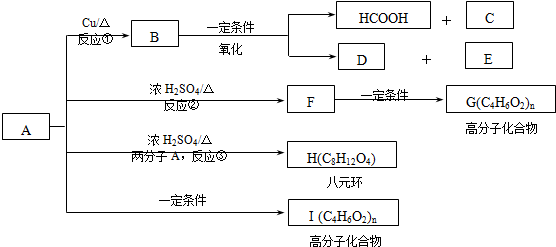
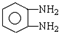 )生成一种合成纤维:
)生成一种合成纤维: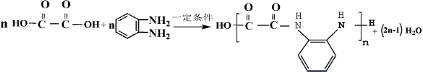 .
.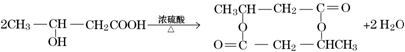 .
.