题目内容
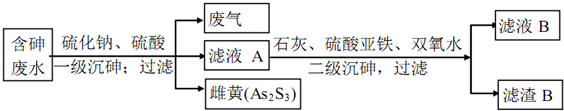
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是( )

| A、若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol?L-1?s-1 |
| B、t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度 |
| C、B的起始物质的量为0.02 mol |
| D、该化学反应的表达式为:3A(g)?B(g)+2C(g) |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A、依据反应速率v=
进行计算;
B、t4~t5阶段正逆反应速率减小且相等,如是降低温度,平衡移动发生移动,则正逆反应速率不相等;
C、根据C、A浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式,根据化学方程式计算;
D、根据C、A浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式.
| △c |
| △t |
B、t4~t5阶段正逆反应速率减小且相等,如是降低温度,平衡移动发生移动,则正逆反应速率不相等;
C、根据C、A浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式,根据化学方程式计算;
D、根据C、A浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式.
解答:
解:A、若t1=15s,生成物C在t0~t1时间段的平均反应速率为:v=
=
mol?L-1?s-1=0.004mol?L-1?s-1,故A正确;
B、t4-t5阶段,反应速率同等程度的减小,则该反应为反应前后体积不变的反应,改变的条件为减小压强;t5~t6阶段,如果增大反应物的浓度正反应速率变大,瞬间逆反应速率不变,根据图象可知t5~t6阶段应为升高温度,故B正确;
C、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)?B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故C错误;
D、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)?B(g)+2C(g),故D正确.
故选C.
| △c |
| △t |
| 0.11-0.05 |
| 15 |
B、t4-t5阶段,反应速率同等程度的减小,则该反应为反应前后体积不变的反应,改变的条件为减小压强;t5~t6阶段,如果增大反应物的浓度正反应速率变大,瞬间逆反应速率不变,根据图象可知t5~t6阶段应为升高温度,故B正确;
C、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)?B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故C错误;
D、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)?B(g)+2C(g),故D正确.
故选C.
点评:本题考查化学平衡移动图象题,题目难度较大,注意从乙图判断各阶段的影响因素,此为解答该题的关键.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
常温下,已知某溶液中水电离的c(H+)=10-12 mol/L,那么,该溶液中可能大量共存的离子是( )
| A、Na+、NH4+、Cl-、CH3COO- |
| B、K+、Fe2+、SO42-、NO3- |
| C、Na+、K+、CO32-、ClO- |
| D、Al3+、Cu2+、SO42-、HS- |
用足量的锌粒和一定量的稀硫酸反应制备H2,向该稀硫酸中加入下列溶液,能使反应的速度减慢,又不影响生成H2的总量(同温同压下),该溶液一定不可能为( )
| A、K2CO3 |
| B、BaCl2 |
| C、CH3COONa |
| D、Na2SO4 |
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题: