题目内容
 将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:
将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:(1)写出下列各段过程中发生反应的离子方程式:
①O→V1
②V1→A
③A→B
(2)当V1=140mL时,金属混合物中m(Mg)=
考点:镁、铝的重要化合物,离子方程式的书写,化学方程式的有关计算
专题:图示题
分析:(1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
(2)由图可知,0~V1发生H++OH-=H2O,V1~A发生Mg2+、Al3+转化为沉淀的反应,A→B段发生Al(OH)3+OH-=AlO2-+2H2O,结合反应及原子守恒计算解答.
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
(2)由图可知,0~V1发生H++OH-=H2O,V1~A发生Mg2+、Al3+转化为沉淀的反应,A→B段发生Al(OH)3+OH-=AlO2-+2H2O,结合反应及原子守恒计算解答.
解答:
解:(1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
故答案:①H++OH-=H2O;②Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3;③Al(OH)3+OH-=AlO2-+2H2O;
(2)若V1=140mL,说明盐酸有剩余,剩余盐酸的物质的量=1mol/L×0.14L=0.14mol,则和金属反应的盐酸的物质的量=4mol/L×0.1L-0.14mol=0.26mol,
设镁的物质的量是x,铝的物质的量是y,
,解得x=0.04mol,y=0.06mol,
即镁的质量是0.04mol×24g/mol=0.96g,
B点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.06mol+0.4mol=0.46mol,所以氢氧化钠的体积=
=460mL,
故答案为:0.96;460.
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
故答案:①H++OH-=H2O;②Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3;③Al(OH)3+OH-=AlO2-+2H2O;
(2)若V1=140mL,说明盐酸有剩余,剩余盐酸的物质的量=1mol/L×0.14L=0.14mol,则和金属反应的盐酸的物质的量=4mol/L×0.1L-0.14mol=0.26mol,
设镁的物质的量是x,铝的物质的量是y,
|
即镁的质量是0.04mol×24g/mol=0.96g,
B点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.06mol+0.4mol=0.46mol,所以氢氧化钠的体积=
| 0.46mol |
| 1mol/L |
故答案为:0.96;460.
点评:本题以图象形式考查混合物计算,难度中等,清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A、MgO、Al2O3、SO2、CO2 |
| B、CO2、Cl2、CaO、SO3 |
| C、Cl2、Al2O3、N2O3、SO3 |
| D、SiO2、N2O5、CO、Cl2 |
下列各组反应中能得到Al(OH)3的是( )
| A、Al2O3加到热水中 |
| B、向NaAlO2溶液中加入过量盐酸 |
| C、将Na投入到NaAlO2溶液中 |
| D、在AlCl3溶液中滴几滴NaOH溶液 |
以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
| A、氢氧化钠溶液 |
| B、氢氧化钡溶液 |
| C、氨水 |
| D、澄清的石灰水 |
靛青是一种染料,利用元素分析仪分析其样品,发现它只含碳、氢、氧、氮四种元素,四种元素的质量分数分别如下:碳为73.3%、氢为3.8%、氮为10.7%、氧为12.2%.则靛青的最简式为( )
| A、C8H5NO |
| B、C2H2NO |
| C、C4H6NO |
| D、C7H8NO |
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
| A、大理石雕像被酸雨腐蚀毁坏 |
| B、充有氢气的气球遇明火爆炸 |
| C、铁制菜刀生锈 |
| D、铜铸塑像上出现铜绿[Cu2 (OH)2CO3] |
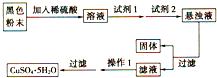 若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是
若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是
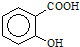 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式