题目内容
NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、O2和O3共32 g混合物中氧原子的个数为2NA |
| B、78 g苯含有C═C 键的数目为3NA |
| C、1 mol Na2O2固体中含离子总数为4NA |
| D、足量Fe与1 mol 氯气反应时转移的电子数为3NA |
考点:阿伏加德罗常数
专题:
分析:A.臭氧和氧气分子中都只含有氧原子,32g二者的混合物中含有32g氧原子;
B.苯分子中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键;
C.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子;
D.1mol氯气与铁完全反应最多得到2mol电子.
B.苯分子中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键;
C.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子;
D.1mol氯气与铁完全反应最多得到2mol电子.
解答:
解:A.32g臭氧和氧气的混合物中含有32g氧原子,含有2mol氧原子,含有的氧原子的个数为2NA,故A正确;
B.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故B错误;
C.1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子,含离子总数为3NA,故C错误;
D.铁与氯气的反应中,1mol氯气完全反应最多得到2mol电子,转移的电子数为2NA,故D错误;
故选A.
B.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故B错误;
C.1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子,含离子总数为3NA,故C错误;
D.铁与氯气的反应中,1mol氯气完全反应最多得到2mol电子,转移的电子数为2NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确苯分子中的碳碳键为一种介于单键和双键之间的独特键,选项C为易错点,注意过氧化钠中阴离子为过氧根离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 新型的乙醇电池结构如图所示,它用磺酸类质子(H+)溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全.已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O.下列说法不正确的是( )
新型的乙醇电池结构如图所示,它用磺酸类质子(H+)溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全.已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O.下列说法不正确的是( )| A、a极为电池的负极,该电极发生氧化反应 |
| B、电池工作时电流由b极沿导线经灯泡再到a极 |
| C、电池正极的电极反应式为:O2+2H2O+4e-=4OH- |
| D、电池工作时,1mol乙醇被氧化转移12 mol电子 |
下列有关物质分类或归纳正确的是( )
①电解质:明矾、冰醋酸、氯化银、纯碱
②同素异形体:金刚石、石墨;C60、C70
③混合物:盐酸、漂白粉、水玻璃、水银
④化合物:BaCl2、Ca(OH)2、HNO3、HT.
①电解质:明矾、冰醋酸、氯化银、纯碱
②同素异形体:金刚石、石墨;C60、C70
③混合物:盐酸、漂白粉、水玻璃、水银
④化合物:BaCl2、Ca(OH)2、HNO3、HT.
| A、①② | B、②③ | C、③④ | D、②④ |
下列说法错误的是( )
| A、化学反应中的能量变化都表现为热量变化 |
| B、需要加热才能发生的反应不一定是吸热反应 |
| C、向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的 |
| D、反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
同温同压下,下列关于氢气和氧气的叙述中,错误的是( )
| A、等体积的氢气和氧气所含的分子数相等 |
| B、氢分子与氧分子大小相同 |
| C、氢分子间的平均距离和氧分子间的平均距离几乎是相等的 |
| D、氢分子和氧分子本身的大小对于气体体积影响可以忽略不计 |
(B做)有一空瓶的质量为20g,问该瓶中充入氧气后的质量为36g,在相同的条件下充入某气体,其质量为34g,则该气体的摩尔质量为( )
| A、44g/mol |
| B、28g/mol |
| C、64g/mol |
| D、32g/mol |
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A、MgO、Al2O3、SO2、CO2 |
| B、CO2、Cl2、CaO、SO3 |
| C、Cl2、Al2O3、N2O3、SO3 |
| D、SiO2、N2O5、CO、Cl2 |
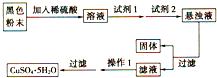 若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是
若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是