题目内容
12.能正确表示下列反应的离子方程式的是( )| A. | 向FeI2溶液中加入少量氯水2Fe2++Cl2=2Fe3++2Cl- | |
| B. | NaClO (aq) 中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
分析 A.少量氯水只氧化碘离子;
B.发生氧化还原反应生成硫酸钠;
C.反应生成的HClO在离子反应中保留化学式;
D.反应生成碳酸钙和HClO.
解答 解:A.向FeI2溶液中加入少量氯水的离子反应为2I-+Cl2=I2+2Cl-,故A错误;
B.NaClO (aq) 中通入过量 SO2的离子反应为C1O-+SO2+H2O=2H++Cl-+SO42-,故B错误;
C.氯气通入水中的离子反应为Cl2+H2O=H++Cl-+HClO,故C错误;
D.次氯酸钙溶液中通入少量CO2的离子反应为Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
2.配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的是( )
| A. | 称量的NaOH固体已经潮解 | |
| B. | 洗涤后的容量瓶中留有少量蒸馏水 | |
| C. | 转移溶解液时,溶解液未冷却至室温 | |
| D. | 定容时俯视容量瓶的刻度线 |
3.分类是化学学习与研究的常用方法,下列分类正确的是( )
| A. | Cl2O7、P2O5、SO3、CO2、NO2均属于酸性氧化物 | |
| B. | K2O、K2O2、KO2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| C. | 根据能否发生丁达尔效应,可以区分胶体和溶液 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
20.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol?L-1、0.001mol?L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol?L-1)的用量均为2mL.
(1)请完成以下实验设计表:
(2)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时)
计算用0.001 mol?L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol•L-1•min-1(忽略混合前后溶液体积的变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
(1)请完成以下实验设计表:
| 实验 编号 | T/K | 催化剂的 用量/g | KMnO4酸性溶液 的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
| KMnO4酸性溶液的浓度/mol.L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
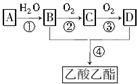 已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下:
已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下: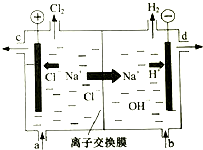 工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.
工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.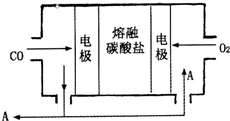 用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.
用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.