题目内容
CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2+H2
CO+H2O.在一定温度下,平衡有90%的H2变成了H2O,且c(CO2)?c(H2)=c(CO)?c(H2O),则原混合气中CO2和H2的分子数之比是( )
| 850℃ |
| A、1:1 | B、1:5 |
| C、9:1 | D、1:10 |
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡的三段式列式结合题干条件中氢气转化率计算得到消耗量,计算;c(CO2)?c(H2)=c(CO)?c(H2O),说明平衡常数等于1;
解答:
解:设原混合气体中CO2和H2的物质的量分别为x、y,体积为1L,在一定温度下,平衡有90%的H2变成了H2O消耗氢气0.9y,依据化学平衡三段式列式计算;
CO2+H2
CO+H2O
起始量(mol/L) x y 0 0
变化量(mol/L)0.9y 0.9y 0.9y 0.9y
平衡量(mol/L)x-0.9y 0.1y 0.9y 0.9y
依据c(CO2)?c(H2)=c(CO)?c(H2O)得到:(x-0.9y)×0.1y=0.9y×0.9y
计算得到x:y=9:1
故选C.
CO2+H2
| 850℃ |
起始量(mol/L) x y 0 0
变化量(mol/L)0.9y 0.9y 0.9y 0.9y
平衡量(mol/L)x-0.9y 0.1y 0.9y 0.9y
依据c(CO2)?c(H2)=c(CO)?c(H2O)得到:(x-0.9y)×0.1y=0.9y×0.9y
计算得到x:y=9:1
故选C.
点评:本题考查了化学平衡的计算应用,掌握平衡常数含义,平衡三段式计算分析是解题关键,题目难度中等.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、碳酸氢钠的水解反应:HCO3-+H2O═CO32-+H3O+ | ||||
| B、硝酸银溶液中滴加过量氨水:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O | ||||
C、以铜作电极电解硫酸铜溶液:2Cu2++2H2O
| ||||
| D、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |

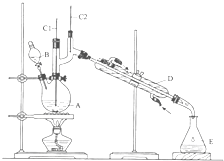 正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛.
 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.