题目内容
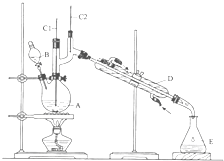 正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛.发生的反应如下:CH3CH3CH3CH3OH
| ||
| H2SO4 △ |
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/g?cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由
(2)加入沸石的作用是
(3)上述装置图中,B仪器的名称是
(4)分液漏斗使用前必须进行的操作是
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在
(6)反应温度应保持在90~95℃,其原因是
(7)本实验中,正丁醛的产率为
考点:有机物的合成,醇类简介
专题:实验题
分析:(1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加;
(3)B仪器的名称是滴液漏斗,D仪器的名称直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏;
(5)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算.
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加;
(3)B仪器的名称是滴液漏斗,D仪器的名称直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏;
(5)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算.
解答:
解:(1)因为浓硫酸的密度大,能将Na2Cr2O7溶液加到浓硫酸中,容易发生迸溅,
故答案为:不能,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加,
故答案为:防止暴沸;冷却后补加;
(3)B仪器的名称是滴液漏斗,D仪器的名称直形冷凝管,
故答案为:滴液漏斗;直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏,
故答案为:c:
(5)正丁醛密度为0.8017 g?cm-3,小于水的密度,故分层水层在下方,
故答案为:下;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=
=51%,
故答案为:51.
故答案为:不能,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加,
故答案为:防止暴沸;冷却后补加;
(3)B仪器的名称是滴液漏斗,D仪器的名称直形冷凝管,
故答案为:滴液漏斗;直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏,
故答案为:c:
(5)正丁醛密度为0.8017 g?cm-3,小于水的密度,故分层水层在下方,
故答案为:下;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=
| 74×2 |
| 72×4 |
故答案为:51.
点评:本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.

练习册系列答案
 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
能用离子方程式“H++OH-═H2O”表示的化学反应是( )
| A、H2SO4+Ba(OH)2═Ba SO4↓+2H2O |
| B、Cu(OH)2+2HCl=CuCl2+2H2O |
| C、NaOH+CH3COOH=CH3COONa+H2O |
| D、KOH+HCl=KCl+H2O |
把氯气通入浓氨水中,会立即发生下列反应:3Cl2+8NH3?H2O═6NH4Cl+N2+8H2O.在标准状况下,把1.12L Cl2、N2的混合气体(90%Cl2和10%N2,均为体积分数)通过浓氨水,实验测得逸出气体体积为0.672L(其中有50%Cl2和50%N2),此反应中被氧化的NH3的质量为( )
| A、3.4 g |
| B、0.34 g |
| C、1.36 g |
| D、4.48 g |
下列变化需加入氧化剂才能完成的是( )
| A、MnO4-→MnO2 |
| B、HCO3-→CO2 |
| C、S2-→HS- |
| D、Br-→Br2 |
下列各组物质在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是( )
| A、FeBr2与Cl2 |
| B、C6H5ONa与CO2 |
| C、HCl与Na2CO3 |
| D、Ca(HCO3)2与NaOH |
CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2+H2
CO+H2O.在一定温度下,平衡有90%的H2变成了H2O,且c(CO2)?c(H2)=c(CO)?c(H2O),则原混合气中CO2和H2的分子数之比是( )
| 850℃ |
| A、1:1 | B、1:5 |
| C、9:1 | D、1:10 |
下列各组离子中,能在溶液中大量共存的是( )
| A、Na+、Cu2+、Cl-、OH- |
| B、H+、Ca2+、CO32-、NO3- |
| C、Ba2+、H+、SO42-、NO3- |
| D、Na+、CO32-、OH-、K+ |

