题目内容
5.(1)某兴趣小组同学汲取热电厂附近的雨水进行实验.雨水样品在空气中放置2小时后,通过测定发现雨水样品的酸性会增强,你认为会形成溶液酸性这一变化的原因是(用离子方程式表示)2H2SO3+O2=4H++2SO42-(2)正常雨水的溶液也是偏酸性,这是因为大气中的CO2溶于雨水
(3)该兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g.计算该空气样品中二氧化硫的体积分数2.24%.
分析 (1)亚硫酸和空气中的氧气反应生成硫酸;
(2)空气中存在CO2溶于水使雨水显酸性,正常雨水的pH值约等于5.6;
(3)利用关系式:SO2~SO42-~BaSO4,根据BaSO4沉淀的质量求出SO2的体积,最后求出体积分数.
解答 解:(1)亚硫酸和空气中的氧气反应生成硫酸,故离子方程式为2H2SO3+O2=4H++2SO42-,
故答案为:2H2SO3+O2=4H++2SO42-;
(2)空气中存在CO2溶于水生成碳酸使雨水显酸性,正常雨水的pH值约等于5.6;
故答案为:大气中的CO2溶于雨水;
(3)利用关系式:SO2 ~SO42-~BaSO4,
0.001mol $\frac{0.233g}{233g/mol}$=1×10-3mol
n(SO2)=n(BaSO4)=1×10-3mol
1L空气中SO2的体积为22.4L/mol×0.001mol=0.0224L,SO2的体积分数为$\frac{0.0224L}{1L}$×100%=2.24%,
故答案为:2.24%.
点评 本题考查物质组成与含量的测定、二氧化硫的性质、氧化还原方程式的书写以及实验原理,注意实验基本操作和物质性质的分析应用,根据原理即可完成,题目难度中等.

练习册系列答案
相关题目
13.下列有关说法中不正确的是( )
| A. | 在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可使蛋白质变性,达到消毒的目的 | |
| B. | 使用光导纤维长距离输送电流,可以降低电能损耗 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 |
16.下列状态的物质,既能导电又属于电解质的是( )
| A. | MgCl2晶体 | B. | NaCl溶液 | C. | 液态氯化氢 | D. | 熔融的KOH |
13.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | NH3常用作制冷剂 | |
| B. | 小苏打用制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 二氧化硅常用于制造光导纤维 |
20.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
17. 伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
 伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )| A. | 该原电池正极的电极方程式为:O2+4e-+4H+═2H2O | |
| B. | 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O | |
| C. | 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g | |
| D. | 该伏打电堆工作时,在银板附近会有Cl2放出 |
14.2017年2月19日在第十三届阿布扎比国际防务展上,采用先进的氢燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录.下列有关氢燃料电池的说法不正确的是( )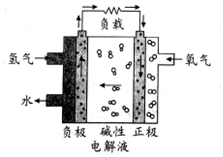

| A. | 通入氢气的电极发生氧化反应 | |
| B. | 正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 碱性电解液中阳离子向通入氢气的方向移动 | |
| D. | 放电过程中碱性电解液的pH不变 |
15.化学与生活密切相关.下列有关说法中错误的是( )
| A. | 纤维素是多糖,但不能作人类的营养物质 | |
| B. | 生理盐水就是物质的量浓度为0.9 mol/L的氯化钠水溶液 | |
| C. | 葡萄酒中可添加适量的二氧化硫起抗氧化、防腐和杀菌等作用 | |
| D. | “卤水点豆腐”就是胶体的聚沉,豆腐、豆腐脑就是凝聚的豆类蛋白质 |